Sommaire
- A. Quel rapport entre la Covid-19 et la pneumonie ?
- B. PCR, test antigénique, quelles différences ?
- B-bis. Tests Covid : pourquoi existe-t-il différentes voies de prélèvement ?
- C. Le SARS-CoV-2 et l’humain viennent-ils de se rencontrer ?
- D. La maladie Covid-19, c’est une grosse grippe ?
- E. Comment limiter la transmission ?
- F. Quelles pistes de vaccin suit-on contre la Covid-19 ?
- G. Pourquoi mettre au point un vaccin prend-il habituellement si longtemps ?
- G.bis – Comment a-t-on pu gagner du temps pour trouver un vaccin contre la Covid-19 ?
- H. Pourquoi le virus ne s’attaque qu’à certains organes ?
- I. Comment une maladie peut-elle passer de l’animal à l’homme ?
- J. Quels traitements contre le SARS-CoV-2 ?
- K. Comment peut-on guérir sans traitement ?
- L. Le SARS-CoV-2 fait-il perdre l’odorat et le goût ?
- M. Hors de son hôte, comment éliminer le virus SARS-CoV-2 ?
- N. Comment peut-on être porteur du virus et ne pas avoir de symptômes ?
- O. Pourquoi certains cas de Covid-19 sont-ils graves ?
- P. Sans anticorps, notre organisme peut-il se défendre ?
- Q. Pourquoi les traitements contre les virus sont-ils très différents de ceux contre les bactéries ?
- R. Comment chercher un antiviral contre le SARS-CoV-2 ?
- S. Mais où est passé le pangolin ?
- T. Pourquoi le sida et le paludisme n’ont-ils pas leurs vaccins ?
- U. Vaccin atténué, inactivé, sous-unitaire, à vecteur ou à ARN, quelles différences ?
- V. D'où viennent les variants ?
- W. Que sont ces variants du SARS-CoV-2 ?
- X. Vaccin à ARN : de l’idée à la production
- Y. Pourquoi une personne vaccinée peut-elle encore transmettre le virus ?
- Z. Pourquoi avons-nous besoin de rappels ?
- 29. Qu'est ce que le Covid long ?
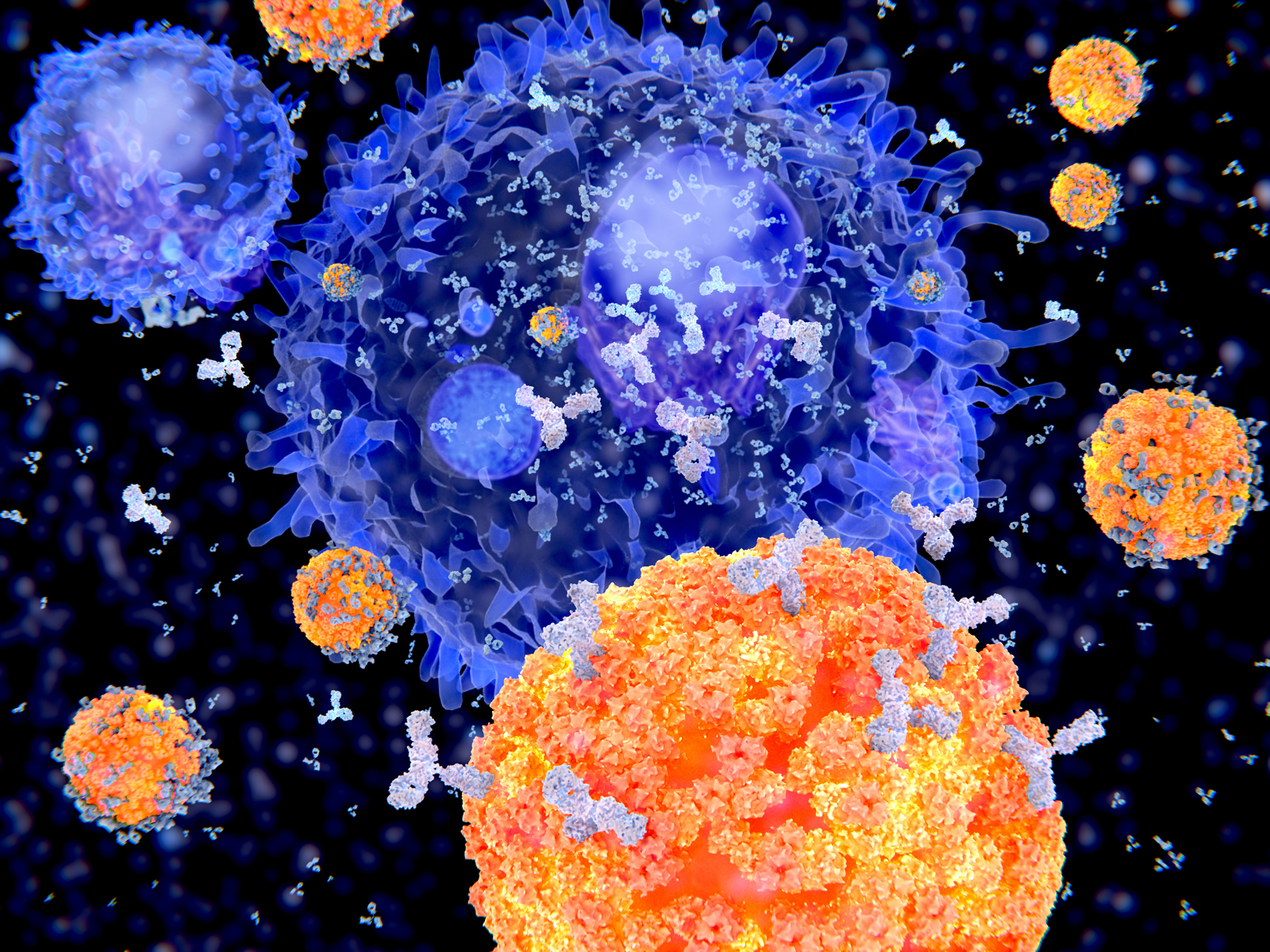
- 30. Comment les anticorps luttent-ils contre le SARS-CoV-2 ?
- 31. Quels sont les effets secondaires des vaccins contre la Covid-19 ?
A. Quel rapport entre la Covid-19 et la pneumonie ?
La maladie Covid-19 se manifeste par une pneumonie particulière. Une pneumonie est une infection des poumons qui apparaît brutalement. Les alvéoles des poumons se remplissent alors de pus et de liquide au lieu de se gorger d’air pour fournir le dioxygène au sang (voir figure). Cela provoque de la fièvre et une toux importante, rend la respiration difficile et douloureuse et limite notamment l’apport d’oxygène à l’organisme.

Généralement les pneumonies sont causées par la prolifération d’une bactérie, comme le pneumocoque, ou d’un virus, comme celui de la grippe influenza ou le récent SARS-CoV-2 provoquant la maladie Covid-19. Dans le cas des bactéries, les alvéoles touchées sont généralement très localisées dans une partie du poumon, tandis qu’une pneumonie virale est, en général, plus étendue : ces différences seront donc visibles en réalisant un scanner des poumons. Mais pour identifier formellement le virus il faut réaliser un prélèvement (voir question B-bis).

informations mises à jour le 19/02/2021

B. PCR, test antigénique, quelles différences ?
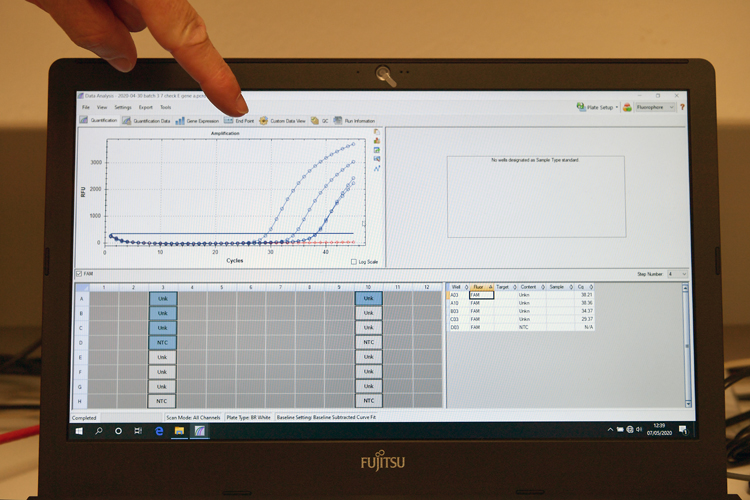
Test RT-PCR : les courbes bleues montrent l’augmentation de fluorescence de tests positifs, la courbe rouge correspond à un prélèvement négatif.
Depuis l’identification du génome du SARS-CoV-2, en un temps record, dès le mois de janvier 2020, plusieurs tests ont été mis au point. Pour détecter la présence du virus dans un prélèvement, deux méthodes sont mises en œuvre : la RT-PCR (réaction en chaîne par polymérase associée à une transcription inverse) et le test antigénique.
La première permet de détecter des quantités extrêmement faibles de virus mais nécessite d’acheminer le prélèvement depuis le laboratoire vers un plateau technique. Après y avoir inactivé le virus en le chauffant, son matériel génétique, l’ARN, est extrait puis mis au contact d’enzymes qui en font un très grand nombre de copies. C’est pourquoi de très faibles quantités du matériel génétique du virus peuvent être ainsi détectées. Pendant cette phase de réplication, si le virus était présent dans le prélèvement, on observe la fluorescence émise par l’échantillon qui augmente régulièrement avec le nombre de copies. Cette méthode est coûteuse en temps, en matériel et en personnel.
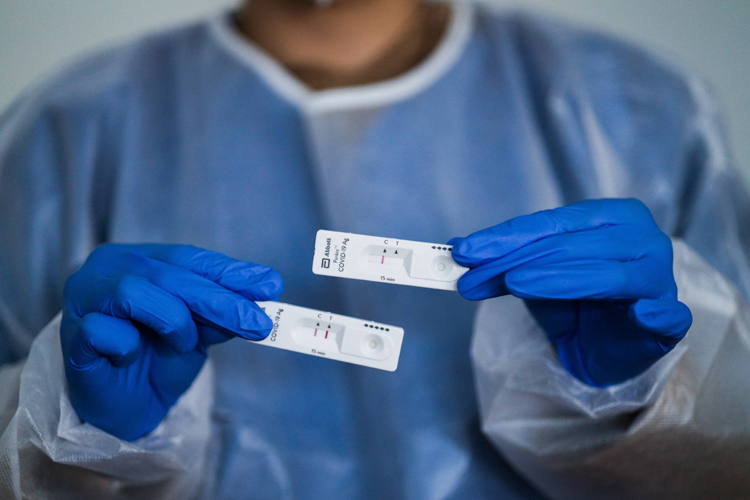
Test antigénique : une bande colorée apparaît à côté de la bande de contrôle si le test est positif.
Plus rapide (de 10 à 30 minutes) mais moins sensible, le test antigénique révèle la présence de la protéine S, située sur l’enveloppe du virus, ou de la protéine N, située à l’intérieur. Ces protéines sont également appelées « antigènes ». Le prélèvement est mélangé à des anticorps qui ne se combinent qu’avec la protéine ciblée, si elle est présente, et provoquent alors l’apparition d’une bande colorée. Mais la présence du virus n’est révélée ainsi que s’il est présent en grande quantité dans le prélèvement. C’est pourquoi la Haute Autorité de santé recommande de réaliser ces tests le plus tôt possible et dans un délai maximum de 7 jours après un contact ou après l’apparition de symptômes. Au-delà, la quantité de virus présente chez les patients risque d’être trop faible. Le prélèvement est à réaliser dans le nasopharynx car il contient plus de virus que la bouche ou la gorge (voir question B-bis).
La période où l’on est le plus contagieux s’étend de 48 heures avant le début des symptômes jusqu’à 7 jours après. La rapidité des tests antigéniques est donc un atout majeur pour limiter la transmission. En outre, ils permettent de repérer les sujets qui ont une concentration élevée de virus et sont donc potentiellement les plus contagieux.

informations mises à jour le 19/02/2021
B-bis. Tests Covid : pourquoi existe-t-il différentes voies de prélèvement ?
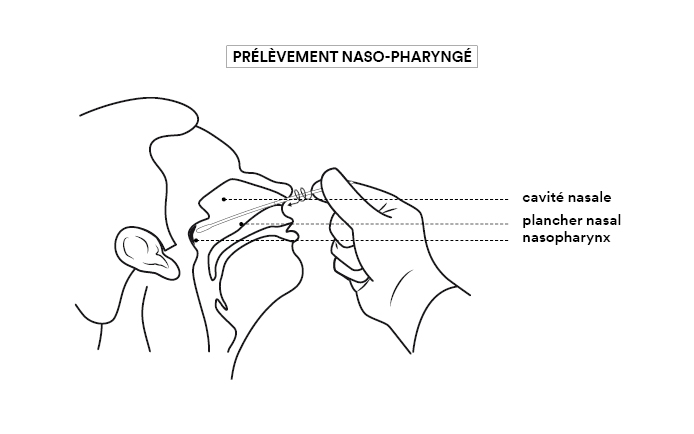
Pour déterminer si une personne est porteuse du SARS-CoV-2, on prélève des sécrétions provenant des voies respiratoires, car c’est là que le virus se loge et se multiplie. Mais il n’est pas présent partout de façon équivalente. On le trouve en abondance dans le pharynx (voir figure).
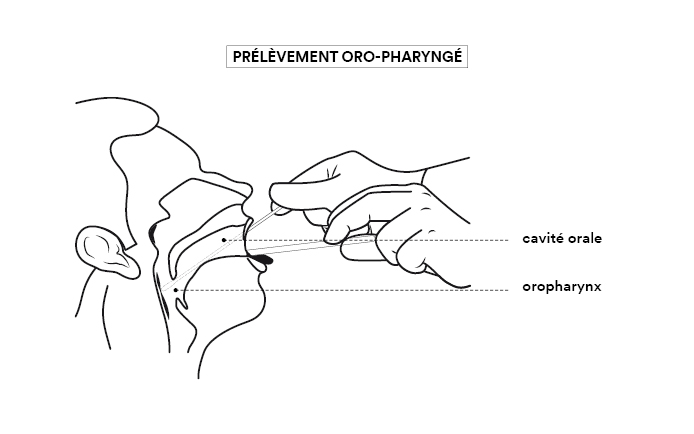
La fiabilité du test est donc la meilleure quand le prélèvement est effectué en introduisant un écouvillon (grand coton-tige) par la narine, le long du plancher nasal jusqu’à la muqueuse du nasopharynx. L’écouvillon est ensuite placé dans un tube contenant un milieu liquide de conservation et sa tige est cassée de façon à fermer le tube. L’acte de prélèvement est désagréable sans être réellement douloureux, mais il peut être difficile à réaliser ou très mal vécu chez certains patients (enfants, personnes présentant des troubles psychiatriques, personnes très âgées). Dans ce cas il est possible d’atteindre le pharynx par la gorge (voie oropharyngée), ce qui est moins désagréable mais peut provoquer un réflexe nauséeux.
On peut également réaliser un prélèvement de salive, par simple crachat du patient ou à l’aide d’une pipette introduite dans la bouche, ce qui est beaucoup plus simple et moins désagréable. Cependant la concentration de virus est beaucoup plus faible dans la bouche que dans le pharynx. Un résultat négatif ne garantit donc pas une absence de virus, ce mode de prélèvement étant moins sensible que les autres. Les tests salivaires doivent être ensuite analysés par la méthode RT-PCR (voir question B), la plus efficace.

informations mises à jour le 19/02/2021
C. Le SARS-CoV-2 et l’humain viennent-ils de se rencontrer ?
Cette question est cruciale pour savoir s’il existe, ou pas, une forme d’immunité contre ce virus dans l’espèce humaine. Si ce n’est pas le cas on parle de virus émergent, soit parce qu’il provient d’un ancien virus qui aurait suffisamment changé par mutation, soit parce qu’il était jusqu’alors inconnu chez l’humain. Le SARS-CoV-2 relèverait du deuxième cas. La plupart des virus émergents (HIV, Ebola, SARS-CoV, MERS-CoV) viennent de réservoirs animaux, c'est à dire d'animaux qui hébergent ces virus sans en être malades.
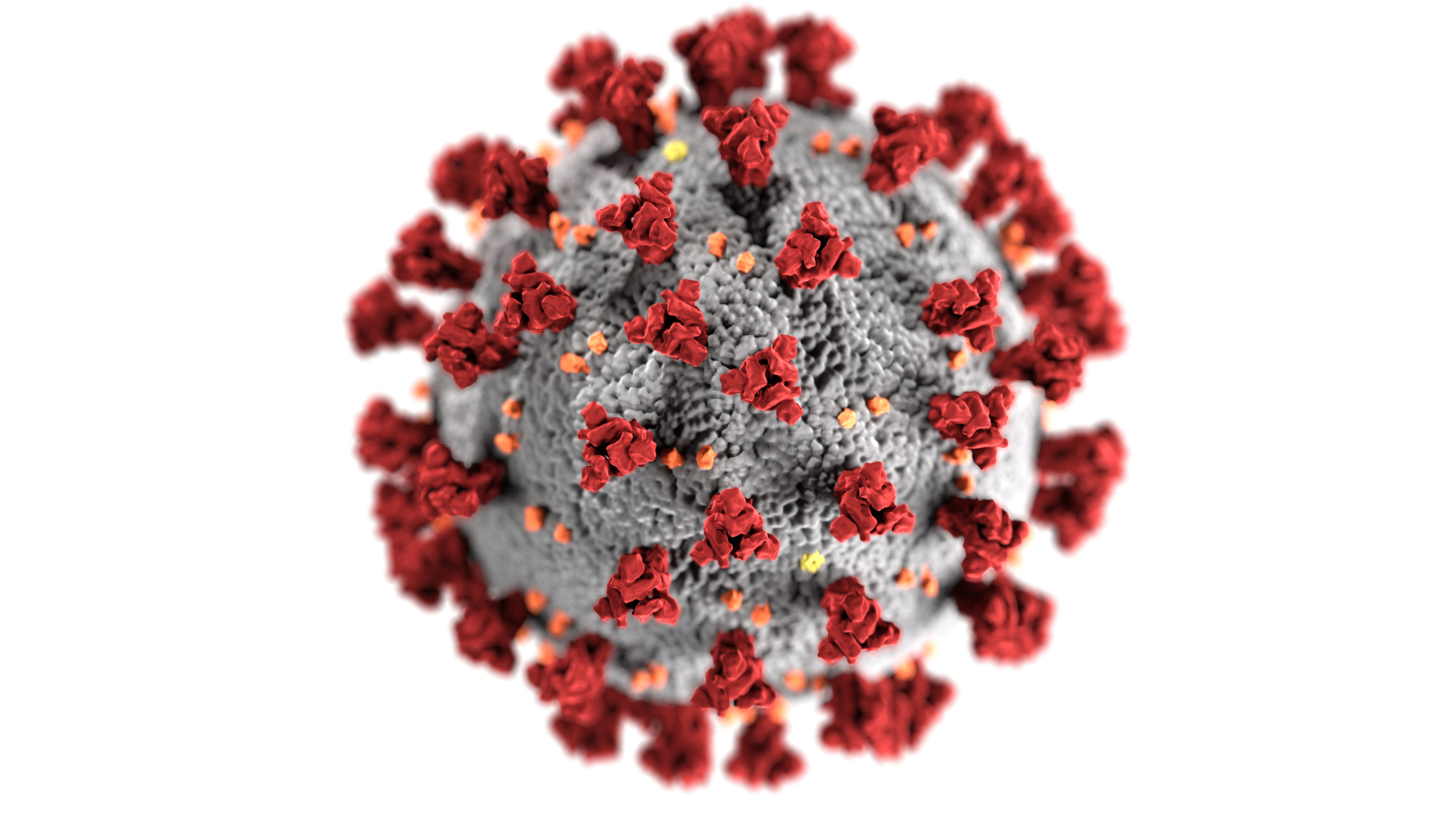
Image reproduisant la morphologie d’un coronavirus, où l’on distingue les spicules répartis tout autour de sa surface
Même s’il existe d’autres coronavirus, celui-ci possède des différences génétiques suffisamment grandes pour être considéré comme nouveau. Par ailleurs, le matériel génétique des coronavirus est connu pour accumuler des changements par mutations au cours du temps. Or, les scientifiques ont démontré que les échantillons du virus SARS-CoV-2 provenant de différents patients étaient génétiquement très proches : le virus n’a donc pas encore eu le temps d’accumuler beaucoup de mutations depuis qu’il est capable d’infecter notre espèce. Ainsi, il est très probable que ce virus n’ait qu’une seule origine animale et n’ait infecté que depuis très récemment l’humain, qui n’avait donc pas d’immunité préexistante.

informations mises à jour le 19/02/2021
D. La maladie Covid-19, c’est une grosse grippe ?
Non, la maladie Covid-19 est différente de la grippe. Et la comparaison est encore plus trompeuse si l’on confond les grippes, dites pandémiques, très rares, et la grippe saisonnière qui circule d’un hémisphère de la planète à l’autre et y séjourne tous les ans tant que les conditions y sont hivernales. Cette dernière est, en général, sans conséquence grave mais occasionne, notamment chez les personnes âgées, une surmortalité qu’on estime tout de même entre 290 000 et 650 000 décès chaque année dans le monde. Les traitements antiviraux et la vaccination empêchent que le bilan ne soit plus lourd.
De son côté, la grippe pandémique est causée à chaque fois qu’un nouveau sous-type de virus apparaît. La « grippe espagnole » de 1918-1919 était causée par un virus H1N1, la grippe asiatique de 1957-1958, par un virus H2N2, et en 2009 un nouveau virus H1N1 s’est propagé. À l’origine de ces épidémies, il y a un transfert d’une espèce animale à l’humain (passage de la barrière d’espèce), puis le virus se propage par contamination interhumaine. Le nouveau virus peut alors infecter une population humaine plus élargie car elle est dépourvue d’anticorps contre lui.
La grippe pandémique est donc un bon modèle pour les épidémiologistes qui cherchent à prédire l’évolution de la maladie Covid-19, mais ils doivent prendre en compte les différences biologiques qui existent entre les deux types de virus. En effet ils appartiennent à des familles distinctes, ne se fixent pas sur les mêmes récepteurs cellulaires de l’hôte et agissent donc différemment. C’est pourquoi il faut rechercher d’autres traitements antiviraux contre la Covid-19.

informations mises à jour le 19/02/2021

E. Comment limiter la transmission ?
Pour contenir ou ralentir la propagation du virus, il est essentiel de connaître ses voies de transmission. Le SARS-CoV-2 se transmet de personne à personne et essentiellement de deux façons : par contact et par voie aérienne. Le virus prolifère dans les tissus de l'arbre respiratoire et se retrouve ensuite dans les sécrétions respiratoires. Il sort de l’organisme sous forme de gouttes de liquide que l’on peut émettre en parlant, avec une portée d’environ 2 mètres, et plus loin encore quand on tousse ou que l’on éternue. Les gouttelettes contenant du virus sont projetées dans l’air puis retombent sur les surfaces. Un sujet sain à proximité peut les inhaler et être infecté. Des microgouttelettes, appelées aérosols, peuvent rester plus longtemps en suspension dans l’air avant de retomber, voire être entraînées par des courants d’aération. On ne sait pas combien de temps le virus reste infectieux dans de telles conditions, mais il est recommandé aux personnes saines de porter un masque pour se protéger des aérosols. La transmission émane de toute personne infectée par le virus, quand bien même elle n’a pas encore déclaré la maladie ou qu’elle reste asymptomatique. Le port du masque est donc également conseillé pour éviter de contaminer les autres en arrêtant physiquement une partie des gouttelettes émises.
Une fois retombées, les gouttelettes émises par une personne déjà infectée se retrouvent sur la peau, les mains et les objets qu’elle a touchés. Il a été démontré en conditions contrôlées au laboratoire que les virus peuvent demeurer actifs hors d’un sujet porteur de quelques heures à quelques jours. Pour le SARS-CoV-2, cette durée semble dépendre de la nature de la surface et augmenter avec l’humidité (voir question M). En touchant les surfaces souillées, un sujet sain se retrouve exposé. Le virus ne rentre pas par la peau mais par le contact des mains sur le nez ou la bouche si elles n’ont pas été lavées. Les scientifiques examinent également la possibilité d’une voie d’entrée par le frottement des mains sur les yeux.
Pour certaines pathologies virales, dont la Covid-19, il existe des personnes infectées qui transmettent le virus à un grand nombre de sujets sains. On parle alors d’événements de « super-propagation ». Cela peut notamment se produire si ces personnes sont entrées en contact avec un grand nombre de sujets, par exemple lors d’un rassemblement, ou si elles possèdent une concentration de virus (charge virale) exceptionnellement élevée. En Corée du Sud, les autorités sanitaires ont examiné l’emploi du temps des premiers cas avérés de Covid-19 et rapportent qu’un de ces cas, avant d’avoir été dépisté positif, a participé à deux rassemblements au sein desquels plus de 1 000 personnes ont ensuite été testées positives.

informations mises à jour le 19/02/2021
F. Quelles pistes de vaccin suit-on contre la Covid-19 ?
Quand nous « tombons malades » et que nous « guérissons », c’est le résultat d’une rencontre entre un microbe et notre système immunitaire (voir question K). Les vaccins utilisent ce phénomène. Lorsque notre système immunitaire défend notre organisme, il a plusieurs cordes à son arc. L’une d’elles est de produire des anticorps neutralisants, qui vont spécifiquement bloquer l’action d’un microbe donné en se fixant sur lui. L’avantage de ce mécanisme de défense est qu’il peut rester « en mémoire » dans notre organisme : les cellules qui produisent les anticorps spécifiques à certains microbes peuvent rester plusieurs années (voire des décennies) dans notre corps, prêtes à répondre encore plus rapidement à la prochaine intrusion de ces mêmes microbes. Cette mémoire explique que nous n’attrapons qu’une seule fois certaines maladies infantiles, comme la rubéole ou les oreillons. Si le même virus attaque une deuxième fois il est immédiatement neutralisé. La vaccination repose sur ce principe de « défense » et de « mémoire ».
Vacciner consiste à simuler une première rencontre entre un microbe et nos cellules de l’immunité, mais sans provoquer la maladie. Si le microbe se présente ensuite, la réponse, notamment de nos anticorps, sera rapide, plus efficace et notre corps mieux protégé. Un des moyens pour créer un vaccin est d’identifier des composants microbiens capables de déclencher la mise en place d’une telle mémoire immunitaire. Pour la recherche d’un vaccin contre le SARS-CoV-2, on gagne du temps en exploitant les travaux réalisés sur le virus SARS-CoV-1, responsable de l’épidémie de 2003, car les spicules qui recouvrent ces deux virus sont très similaires. Aussi appelés protéines S, ils permettent au virus d’entrer dans les cellules cibles (voir question H). Or, des expériences menées in vitro et chez l’animal montrent que des anticorps spécifiques peuvent être produits et bloquer l’entrée du virus dans les cellules en se fixant sur les spicules du SARS-CoV-1. Cela ouvre une piste prioritaire pour la recherche vaccinale contre le SARS-CoV-2.
Parmi plus de 200 candidats vaccins, dont une soixantaine sont en phase clinique, différentes techniques sont utilisées. Il s’agit de mettre en contact ces spicules du SARS-CoV-2 avec l’organisme afin qu’il produise des anticorps dirigés contre eux. Pour ce faire, les approches classiques consistent à injecter ces protéines S. Mais la première technique à recevoir une autorisation conditionnelle de mise sur le marché en Europe se base sur une autre stratégie : faire fabriquer temporairement la protéine S par nos propres cellules.

informations mises à jour le 19/02/2021
G. Pourquoi mettre au point un vaccin prend-il habituellement si longtemps ?
La mise au point d’un vaccin se fait en plusieurs étapes. En premier lieu il faut comprendre comment le microbe fonctionne : comment il infecte et ce qui le rend pathogène. Ensuite il faut choisir le type de vaccination. Par exemple, cherche-t-on à atténuer la virulence du microbe ? Utilisons-nous un vaccin existant en essayant de l’adapter (voir question F) ? Une fois un prototype prometteur obtenu, viennent les premières étapes de test en laboratoire. Le vaccin est testé en « préclinique » sur des cellules en culture, donc in vitro, puis in vivo sur un petit animal et enfin sur les singes. Il faut vérifier à chaque étape que le vaccin provoque bien une production d’anticorps et de lymphocytes T protecteurs et qu’il n’entraîne pas d’effets secondaires.
Les tests sur populations humaines peuvent alors commencer, on parle ici de phase de recherche clinique. Pour ce faire, des cohortes de volontaires compatibles avec ces tests doivent être recrutées. Il s’agit, à ce stade, de démontrer que l’injection du vaccin ne provoque pas d’effets secondaires, de trouver le juste dosage, le bon rythme des injections successives et de vérifier que les personnes vaccinées produisent bien des anticorps contre le microbe. Une dernière validation à grande échelle du vaccin ne peut être faite que sur une grande cohorte de patients vaccinés. Toutes ces étapes prennent du temps, généralement deux à cinq ans, parfois dix ans ! Suite à sa commercialisation, le vaccin est dans son ultime phase, celui de son suivi au fil des années chez les patients.

informations mises à jour le 19/02/2021


G.bis – Comment a-t-on pu gagner du temps pour trouver un vaccin contre la Covid-19 ?
Contre le SARS-CoV-2, les vaccins sont élaborés dans un temps record, qu’ils soient à ARN ou plus traditionnels. De nombreuses entreprises se sont lancées dans la course avec une seule certitude, acquise lors des recherches sur le virus SARS-CoV-1 : le vaccin doit cibler la protéine S. Pour gagner du temps, la plupart ont mis en œuvre la technique dans laquelle elles ont développé une expertise. Mais fabriquer un vaccin atténué, à vecteur ou sous-protéique prend du temps (voir question U). C’est là que le vaccin à ARN messager a fait la différence : cette molécule est facile à synthétiser.
Ensuite, quel que soit le type de vaccin, les étapes suivantes ont été raccourcies : au lieu de se succéder, les trois phases de recherche clinique se superposent. Pour ces tests, les cohortes à grande échelle sont rapidement constituées car les volontaires ne manquent pas. Si le vaccin s’avère prometteur, les industriels lancent sa production avant même les conclusions définitives des essais. Le risque financier est énorme. Mais il est couvert, en grande partie, par les précommandes considérables des États. Enfin, l’étude des dossiers a été une priorité des grandes agences du médicament. Beaucoup d’obstacles ont donc été levés mais plusieurs questions demeurent. Quelle sera l’efficacité du vaccin sur la population entière et combien de temps durera la protection qu’il procure ?

informations mises à jour le 19/02/2021
H. Pourquoi le virus ne s’attaque qu’à certains organes ?
Les virus ne peuvent pas se multiplier tout seuls. Pour se répliquer, ils ont besoin d’infecter les cellules d’un hôte. Pour cela, les virus ont à leur surface des protéines qui sont de véritables clés d’entrée. En effet, nos cellules possèdent une membrane qui joue le rôle d’une frontière, hautement contrôlée, entre l’intérieur et l’extérieur. Pour autant, les cellules ont naturellement besoin de faire entrer des éléments nécessaires pour elles (comme des acides aminés récupérés après la digestion d’un repas) ou de libérer dans le corps des éléments qu’elles produisent. Ces échanges sont finement régulés par des récepteurs présents à la surface de la cellule. Mais comme les besoins des organes sont différents, les récepteurs de leurs cellules ne sont pas les mêmes. Par exemple une cellule de foie n’a pas les mêmes besoins ni les mêmes récepteurs qu’une cellule de poumon.
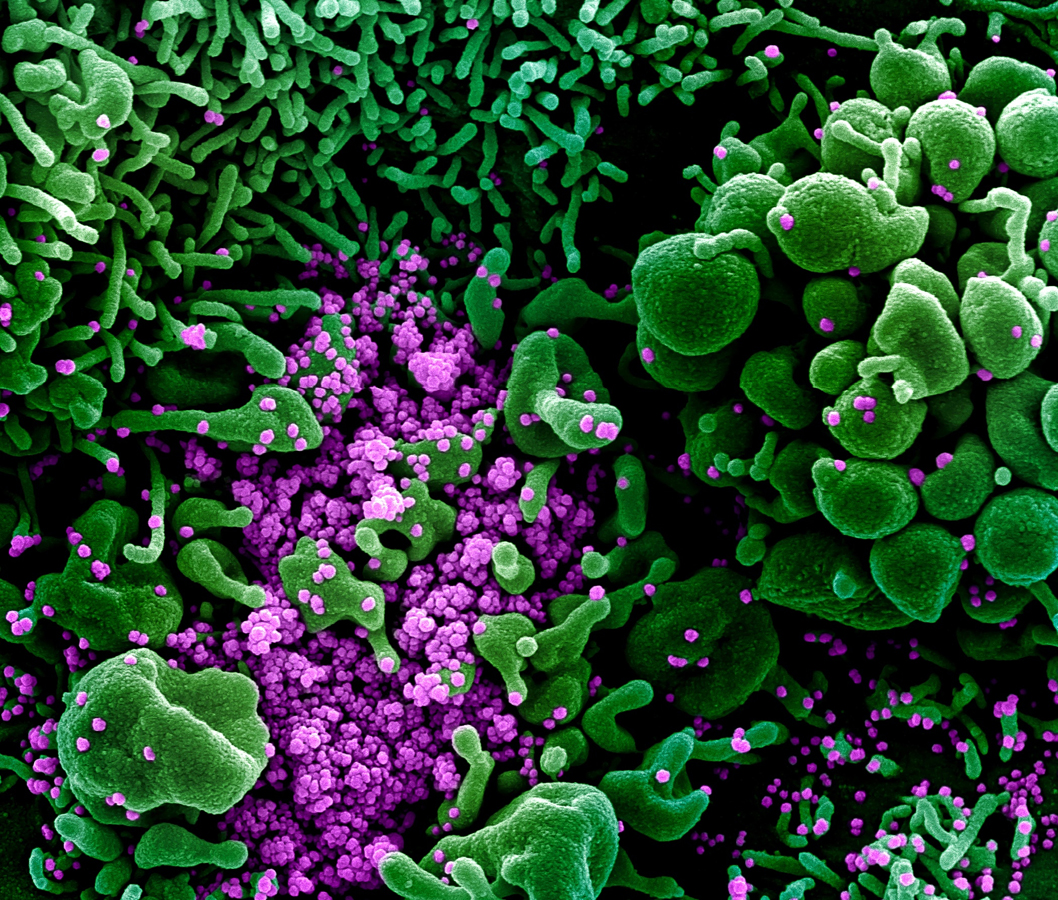
Image du SARS-CoV-2, isolé à partir d’un patient, obtenue par microscopie électronique montrant une cellule (en vert) infectée par le virus (en violet).
Pour qu’un virus soit pathogène pour l’humain, il doit posséder en surface des protéines capables de se lier à des récepteurs présents sur des cellules humaines. Chez les coronavirus, ces protéines sont les « spicules ». Elles forment une sorte de couronne autour du virus (d’où son nom, « corona » signifiant couronne en latin). Du côté des cellules, les récepteurs de ces spicules sont appelés ACE2. Toute cellule qui possède à sa surface des récepteurs ACE2 est donc susceptible d’être infectée. C’est le cas des cellules qui tapissent le nez et la gorge : ce sont les premières infectées, d’autant mieux qu’elles sont facilement accessibles (voir question E). De là, le virus gagne les cellules des alvéoles pulmonaires (voir question A) également pourvues du récepteur ACE2. Puis il peut provoquer la coagulation du sang en infectant les cellules constituant les parois des petits vaisseaux sanguins ayant des récepteurs ACE2. Et c’est également le cas des cellules du cœur, de l’intestin et du rein, que le virus peut donc aussi atteindre.

informations mises à jour le 19/02/2021

I. Comment une maladie peut-elle passer de l’animal à l’homme ?
Quand un micro-organisme, présent initialement dans la faune sauvage ou domestique, provoque une maladie infectieuse humaine, on appelle cela une zoonose. Pour qu’elle émerge, une première transmission d’animal à homme doit avoir lieu. Cela implique une rupture de la barrière d’espèce, c’est-à-dire que le micro-organisme en évoluant et à force de contacts répétés avec le nouvel hôte parvient à s’y développer. L’histoire est jalonnée d’exemples : la maladie à virus Ebola, le sida ou encore la grippe aviaire.
À l’origine, un micro-organisme est particulièrement adapté à une ou plusieurs espèces. C’est le cas de bon nombre de coronavirus, dont on sait qu’ils sont établis et circulent chez les chauves-souris. Celles-ci ont la particularité d’héberger ces virus sans en être malades car elles sécrètent en permanence des interférons (voir question N). Elles constituent donc un très bon « réservoir ». Passer d’un réservoir primaire, comme la chauve-souris, à un nouvel hôte implique une combinaison d’événements. Des sauts sporadiques peuvent avoir lieu : un virus passe accidentellement entre individus d’espèces différentes qui n’ont pas nécessairement de symptôme. Ces opportunités de transmission sont favorisées par des changements climatiques ou des modifications d’écosystèmes, comme la déforestation. Cela crée des contacts entre espèces qui ne se seraient pas produits sinon. De plus, les épidémies liées aux coronavirus mettent en évidence le rôle clé d’un autre animal faisant l’intermédiaire entre l’espèce réservoir et l’humain. Il s’agit souvent d’un animal dont la rencontre avec l’humain est plus fréquente, comme la civette lors de l’épidémie de SRAS en 2003 ou le dromadaire pour l’épidémie persistante de MERS.
Mais ces occasions de transmission ne suffisent pas à elles seules pour expliquer la rupture d’une barrière d’espèce. La compatibilité du virus avec le nouvel hôte est également déterminante dans sa capacité à l’infecter efficacement et à se transmettre ensuite d’individu à individu. Ces aptitudes peuvent s’acquérir de manière aléatoire à mesure que des changements, des mutations, dans le matériel génétique du virus apparaissent. Les coronavirus sont particulièrement prompts à muter. Couplés aux changements démographiques et aux mouvements de population, ces mécanismes participent au déclenchement ponctuel d’épidémies, voire de pandémies comme nous le voyons aujourd’hui avec la Covid-19.

informations mises à jour le 11/10/2022
J. Quels traitements contre le SARS-CoV-2 ?
Le protocole médical de prise en charge des patients atteints de la Covid-19 a beaucoup évolué. Au début de l’épidémie, il visait à atténuer les symptômes en diminuant la fièvre ou en utilisant des appareils d’assistance respiratoire. Il s’agissait de donner le temps au système immunitaire des patients de les guérir (voir question K). Très vite, des anticoagulants ont été ajoutés à cet arsenal quand on a compris que le virus pouvait provoquer la coagulation du sang (voir question H).Peu à peu les patients ont pu bénéficier de traitements curatifs, ceux-ci étant, pour une part, issus de traitements actifs dans d’autres maladies.
Le premier médicament ayant montré un bénéfice conséquent en termes de réduction de la mortalité est un corticoïde, utilisé dans des affections pulmonaires, la dexaméthasone. Cette molécule réduit d’un tiers la mortalité chez des patients atteints d’une forme sévère de la Covid-19 sous assistance respiratoire. En revanche, elle ne montre aucun bénéfice sur des patients souffrant d’une atteinte faible à modérée. Son efficacité tient dans sa capacité à contrer l’inflammation exagérée due à la Covid-19 (voir question O).Comme les autres corticoïdes, elle agit en pénétrant dans les cellules et en modifiant leur activité : les cellules immunitaires produisent alors moins de facteurs favorisant l’inflammation et, pour certaines, plus de molécules anti-inflammatoires. Si l’on se rappelle que l’inflammation est une réaction défensive de l’organisme, on comprend qu’un usage trop précoce de la dexaméthasone pourrait empêcher le système immunitaire de s’opposer à la multiplication du virus. C’est une explication probable de son absence d’efficacité sur les patients non gravement atteints, voire de l’apparition d’effets favorisant la maladie. Donné trop tôt, il affaiblit nos défenses, donné plus tard, il limite l’inflammation démesurée et devient alors bénéfique. Voilà pourquoi il est fondamental de déterminer précisément le stade de la maladie où ce médicament doit être administré (voir illustration).
Cette préconisation est généralisable aux autres anti-inflammatoires efficaces contre la Covid, comme le baricitinib et le tocilizumab, deux traitements également utilisés contre la polyarthrite rhumatoïde. Ce dernier anti-inflammatoire utilise une technologie rodée : celle des anticorps monoclonaux. D’ordinaire, les anticorps synthétisés par notre système immunitaire sont variés et se fixent sur des cibles très différentes. À l’inverse, les anticorps monoclonaux sont tous identiques. Ces molécules, produites industriellement, se fixent sur une seule cible. Ils peuvent permettre de révéler la présence d’une molécule particulière, comme ceux utilisés dans les tests de grossesse, ou bien agir comme un grain de sable dans un rouage. C’est le cas des anticorps monoclonaux du tocilizumab, qui ont été développés pour se fixer sur un récepteur impliqué dans l’inflammation et le rendre inopérant. Ils diminuent la mortalité de 20 %.
Une autre classe de médicaments existe pour contrer la Covid : les antiviraux. Ceux-là doivent être administrés pendant la période de multiplication du virus, c’est-à-dire dans les jours suivants les premiers symptômes. Leur rôle est d’enrayer cette multiplication. Ronapreve®, Evusheld®, Xevudy® sont des antiviraux. Ils sont, eux aussi, basés sur l’utilisation des anticorps monoclonaux. Ici la cible est la spicule S du SARS-CoV-2, cette protéine par laquelle le virus s’attache à la cellule qu’il va infecter. Une fois la spicule recouverte par les anticorps, le virus ne peut s’arrimer à cette cellule et donc y pénétrer pour s’y multiplier. Mais la spécificité de ces anticorps est leur talon d’Achille. Des changements dans la conformation de la spicule peuvent empêcher leur fixation. Ainsi le Ronapreve®, s’il est efficace contre le variant Delta – il divise par trois le risque d’hospitalisation – ne l’est plus contre le variant Omicron. Et les traitements Evusheld et Xevudy souffrent d’une perte d’efficacité contre ce même variant.
Le Paxlovid®, autre antiviral, évite cet écueil puisqu’il inactive une molécule peu touchée par les mutations du virus : un ciseau moléculaire. Ce médicament, qui n’est pas un anticorps monoclonal, empêche les virus de se former dans la cellule infectée. Au moment de sortir de la cellule, les différents éléments des virus sont liés ensemble comme les pièces d’un puzzle qu’il faut détacher avant de les assembler correctement. Le Paxlovid rend cette séparation impossible. Les virus ne forment pas leur coque (voir question Q) et leur réplication est interrompue. L’efficacité annoncée du traitement dépasse 80 %, mais il ne se substitue pas à la vaccination.

informations mises à jour le 13/10/2022

Caractéristiques et prise en charge de la Covid-19.
Le choix des traitements contre la Covid-19 dépend du stade et de la gravité de la maladie. Les antiviraux sont efficaces quand la réplication du SARS-CoV-2 est importante, c’est-à-dire avant ou peu après l’apparition des symptômes. Les anti-inflammatoires sont utilisés plus tardivement.
K. Comment peut-on guérir sans traitement ?
Sans traitement, une majorité des malades de la Covid-19 parvient tout de même à guérir. Comment font-ils ? Quand nous tombons malade et que nous guérissons « naturellement », c’est-à-dire sans traitement spécifique, c’est parce que notre organisme possède un ensemble de mécanismes permettant de lutter contre l’infection : la réponse immunitaire. Elle se déroule en deux temps ; d’abord se déclenche l’immunité innée puis vient l’immunité adaptative La première est immédiate, la seconde particulièrement efficace.
Dès qu’un microbe étranger pénètre dans l’organisme, les cellules de l’immunité innée, présentes comme des sentinelles, détectent l’intrus en repérant des éléments de son matériel génétique ou bien des molécules présentes à sa surface. Elles secrètent des substances chimiques qui alertent de nouvelles cellules de l’immunité afin qu’elles viennent en renfort, et attirent des cellules de l’inflammation qui vont aider leur passage et déclencher un processus d’ingestion et de digestion du microbe, processus qu’on appelle la phagocytose.
Si le microbe est déjà connu de l’organisme et qu’il est encore « en mémoire », l’immunité acquise se déclenche également très vite et agit de façon très efficace contre le microbe. Ce n’est malheureusement pas le cas à l’égard du SARS-CoV-2, qui est nouveau pour nous tous. L’immunité acquise est, dans ce cas, plus lente à s’amorcer. Des morceaux de microbe issus de la phagocytose permettent de déclencher une sélection des globules blancs les mieux adaptés pour lutter contre le microbe. Ils se multiplient et certains produisent en grande quantité des anticorps spécifiques contre le microbe, capables de le neutraliser. Certaines cellules intervenues dans ce processus persistent longtemps après l’élimination du microbe et permettent d’en garder la mémoire.
Pour la Covid-19, il a été démontré que les patients qui guérissent ont produit des anticorps dirigés contre le virus dans leur sang. La durée pendant laquelle notre corps peut continuer de les produire n’est cependant pas encore connue. C’est d’ailleurs l’un des enjeux de la vaccination actuelle : obtenir un vaccin qui procurera une immunité adaptative pour une durée la plus longue possible. . Les chercheurs proposent également de développer une sérothérapie dirigée contre le SARS-CoV-2, consistant à récupérer des anticorps dans le sang de patients guéris pour les injecter chez les patients aux symptômes graves afin d’aider leur immunité à lutter efficacement contre le virus.

informations mises à jour le 19/02/2021
L. Le SARS-CoV-2 fait-il perdre l’odorat et le goût ?
Sept patients sur dix atteints de Covid-19 font état d’une perte d’odorat, accompagnée ou non d’une altération du sens du goût. Dans ce cas, c’est la perception des saveurs qui est altérée. La proportion élevée des personnes touchées explique l’utilisation de ces symptômes pour aider au diagnostic de la Covid-19.
La perte d’odorat, suite à une infection, est un phénomène bien connu dans différentes pathologies communes, comme le rhume ou la grippe saisonnière. Un cas a également été décrit chez un patient atteint lors de l’épidémie de SRAS (syndrome respiratoire aigu sévère, maladie causée par le coronavirus SARS-CoV-1) en 2003. La plupart du temps, cette perte est transitoire, et la récupération se fait dans des délais très variables, de quelques jours à plusieurs années selon les patients.
L’odorat a plus d’importance qu’on ne le croit. En temps normal, nous percevons les odeurs quand des molécules odorantes entrent dans la cavité nasale et se lient aux cils des cellules olfactives. Celles-ci tapissent le haut de cet espace, sur une surface grande comme un timbre-poste : l’épithélium olfactif. L’information parvient ensuite au bulbe olfactif par l’intermédiaire des fibres nerveuses puis est transmise au cerveau. Les molécules odorantes peuvent tout aussi bien provenir de la bouche que de l’air ambiant inhalé par les narines (voir figure). En effet, dans le milieu chaud et humide de la bouche, les aliments mastiqués émettent de nombreuses molécules odorantes qui parviennent à la cavité nasale en empruntant une sorte de passage secret à l’arrière de la bouche : la voie rétro-nasale. C’est pourquoi la perte d’odorat peut affecter considérablement la perception de l’arôme des aliments. Parmi les personnes dites « anosmiques », une sur deux constate une altération des saveurs (salé, sucré, acide, amer, umami) de ses aliments. Si la cause de ce dernier dysfonctionnement demeure incomprise, en revanche, la brusque perte de l’odorat est en partie élucidée. Elle reflète l’invasion, par le virus, des différents éléments de la chaîne de l’olfaction.
L’épithélium olfactif, plus précisément les cellules olfactives, sont infectées. Leurs cils, qui portent les récepteurs chargés de recueillir les molécules odorantes, disparaissent et avec eux l’odorat. Les fibres nerveuses chargées de transmette les informations au cerveau ne sont pas épargnées par l’infection. C’est l’épithélium olfactif dans son ensemble qui est désorganisé. Certaines cellules meurent, des globules blancs arrivent : c’est l’inflammation. Mais ce n’est pas tout : le bulbe olfactif, un élément du cerveau, est également contaminé. Cette voie sensorielle, la voie olfactive, devient une des portes d’entrée du virus vers le système nerveux central.
L’insensibilité aux odeurs peut se maintenir plusieurs mois après la disparition des autres symptômes de la Covid-19. Lorsque c’est le cas, cet état trahit une inflammation persistante de l’épithélium olfactif consécutive à la présence prolongée du virus.
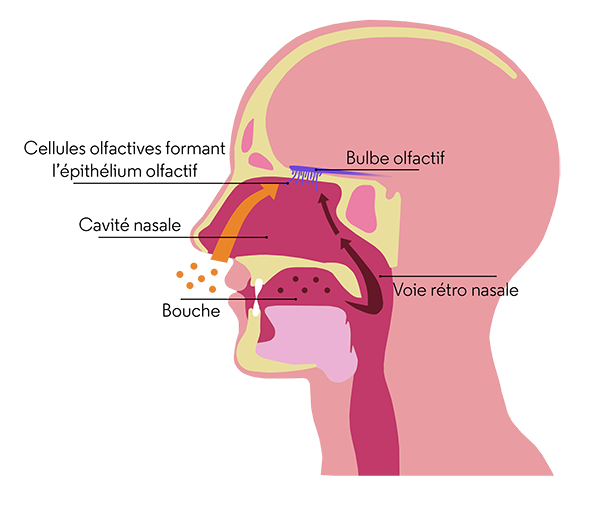
Olfaction directe et rétro-olfaction : deux trajets possibles pour les molécules odorantes.

informations mises à jour le 11/10/2022

M. Hors de son hôte, comment éliminer le virus SARS-CoV-2 ?
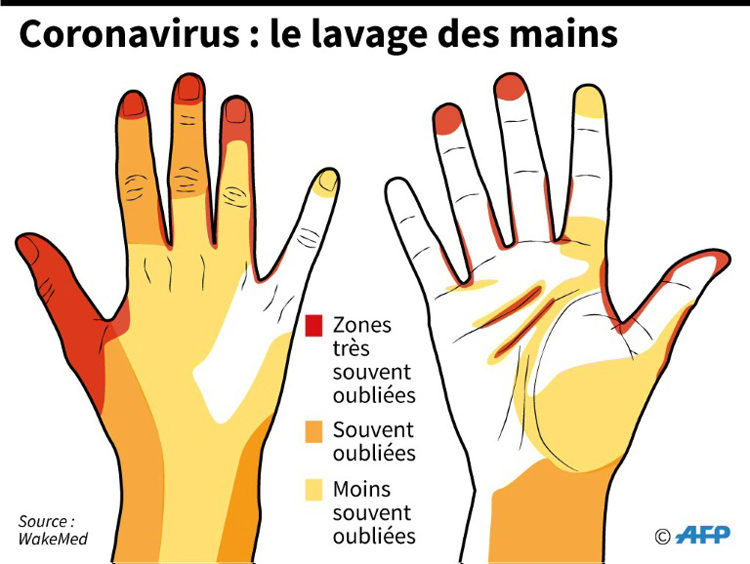
Les virus présents sur une surface, comme une table, une poignée ou nos mains, conservent-ils la capacité d’infecter des cellules ? Pour limiter l’épidémie, cette question est un enjeu clé. Ainsi, des études comparent la stabilité du SARS-CoV-2 dans différents environnements. De premières données suggèrent qu’il faut attendre deux à quatre jours pour que tous les virus présents perdent totalement leur activité. Cela dépend des conditions de température, d’humidité et des matériaux. En conditions très contrôlées en laboratoire, on mesure le temps nécessaire pour que la moitié des virus se désagrègent, diminuant ainsi leur capacité à infecter un hôte. Cette durée est de trois heures environ sur du carton contre presque sept heures sur du plastique.
Ainsi, être en dehors d’un hôte rend le virus vulnérable. Et les virus possédant une enveloppe, comme c’est le cas du SARS-CoV-2, le sont encore plus. Cette enveloppe est constituée principalement de lipides et ressemble beaucoup à la membrane plasmique des cellules, et ce pour une raison simple : l’enveloppe du virus se forme à partir de la membrane cellulaire. En effet, le virus acquiert cette enveloppe en bourgeonnant à partir d’une cellule au moment d’en sortir et il la perd en fusionnant avec une autre cellule au moment d’y entrer. Si cette enveloppe lui est donc indispensable pour infecter une cellule et participe ainsi de sa virulence, elle est aussi sa faiblesse quand il est hors de l’hôte. Aussi fragile qu’une membrane cellulaire, l’enveloppe va souffrir de la température, de la sécheresse et… du savon. Anodin à nos yeux, le savon est une arme d’autant plus intéressante que les mains sont une voie de transmission importante des virus respiratoires.
En effet, le savon contient des molécules, appelées tensioactifs. Les études ont montré que les tensioactifs de type anionique, généralement présents dans nos savons en pain ou liquides, inactivent les virus. Deux mécanismes sont suggérés. Les tensioactifs peuvent s’attacher à la membrane des virus enveloppés et la désagréger. Ils peuvent également se lier aux protéines présentes à la surface du virus et lui faire ainsi perdre tout son pouvoir infectieux. Laver les mains n’agit donc pas seulement pour éloigner le virus mais également pour l’inactiver. Quant à l’alcool, son efficacité a été démontrée sur les virus de type coronavirus mais les mécanismes d’action en jeu ne sont pas précisément décrits. Son efficacité est cependant diminuée sur des mains salies par des matières grasses, alors que le savon reste efficace.

informations mises à jour le 19/02/2021
N. Comment peut-on être porteur du virus et ne pas avoir de symptômes ?
Très tôt, on a soupçonné que l’épidémie de Covid-19 était plus étendue que ce que montrait la détection des signes cliniques confirmés par un dépistage du SARS-CoV-2. Il existe effectivement une part silencieuse de l’épidémie : les infections asymptomatiques (pas de symptômes) et paucisymptomatiques (peu de symptômes). Cela semble être le cas pour la plupart des enfants.
L’une des raisons de cet état de fait est qu’il se joue, au sein de chaque hôte, une véritable course de vitesse entre le virus et la réponse immunitaire. Le résultat de cette course influence fortement l’issue de l’infection et l’intensité des symptômes associés. Dès les premières heures, lorsque le virus est entré dans les cellules de l’arbre respiratoire et a commencé de s’y répliquer, une réponse antivirale est enclenchée. Une cellule infectée est, par exemple, capable de détecter seule la présence d’un génome viral dans son cytoplasme. Elle se met alors à produire diverses molécules comme les interférons de type 1, dont un des rôles est de bloquer en partie le mécanisme de traduction à l’œuvre dans la cellule, la mettant ainsi presque à l’arrêt. La cellule limite alors sa propre capacité à fabriquer des protéines indispensables à son bon fonctionnement, mais empêche surtout la réplication du virus, qui dépend aussi de ce processus. La cellule n’est plus au service du virus et, en sécrétant l’interféron, transmet même le message d’alerte aux cellules avoisinantes, qui reproduisent à leur tour ce mécanisme de blocage. Si la réponse est suffisamment vigoureuse, et l’on pense que c’est par exemple le cas chez les enfants, la réplication virale peut être arrêtée avant l’apparition d’effet massif dû au virus. Pendant quelques heures à quelques jours, une personne peut ainsi être infectée mais ne présenter aucun ou peu de symptômes. Indépendamment de la gravité des symptômes, s’il y en a, les personnes infectées sont potentiellement contagieuses.
Malheureusement, et c’est probablement le cas du SARS-CoV-2, les coronavirus possèdent des armes qui ralentissent fortement la réponse antivirale et, notamment, l’action bénéfique de l’interféron au stade précoce de l’infection. Une des voies de recherche consiste aujourd’hui à comprendre comment le virus réduit l’action de l’interféron afin d’y remédier.
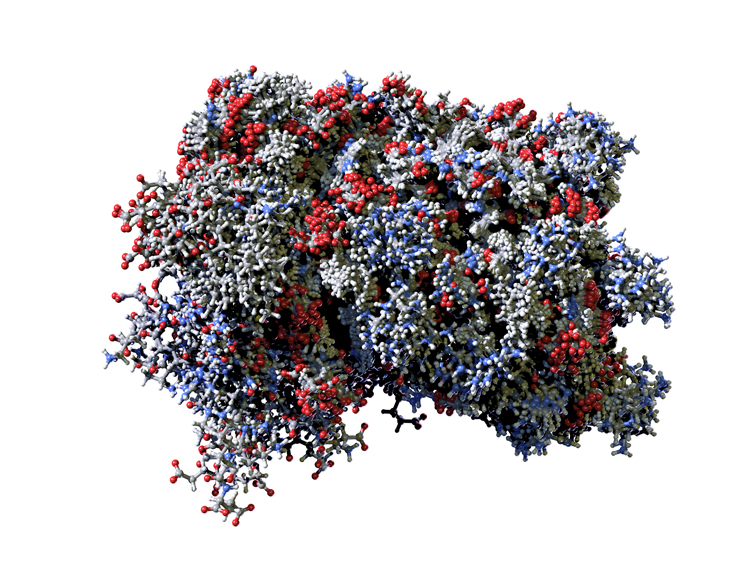
Molécule d’interféron humain. Cette protéine joue un rôle important dans la réponse immunitaire initiée contre le virus.

informations mises à jour le 19/02/2021

O. Pourquoi certains cas de Covid-19 sont-ils graves ?
Chez certains patients, la Covid-19 présente des formes particulièrement sévères. On assiste, chez eux, à un affolement de la réponse immunitaire, cette réaction pourtant chargée de lutter contre les infections.
Lors d’une infection, des globules blancs aptes à détruire les virus et les cellules infectées migrent vers la zone malade. Cet afflux est régulé grâce à des protéines appelées cytokines. Avec le SARS-CoV-2 on constate une surproduction néfaste de cytokines. Les cytokines ne restent pas localisées au lieu de l’infection. Elles diffusent dans tout le corps et déclenchent la défaillance de nombreux organes. On parle d’« orage cytokinique ».
La survenue de cet événement serait favorisée par un système immunitaire moins réactif aux nouvelles infections, comme celui des sujets âgés. Les pathologies chroniques comme l’obésité, certaines atteintes cardiovasculaires ou respiratoires, l’insuffisance rénale, le diabète favorisent aussi cette séquence d’événements. Ces maladies se caractérisent par l’arrivée constante de globules blancs dans les organes malades et l’activation continuelle de cytokine dans ces mêmes organes, particularités qui expliqueraient la grande facilité du système immunitaire à s’emballer
Cependant, des individus relativement jeunes, dont quelques enfants, ont présenté des formes graves de la maladie en l’absence de ces facteurs. Voilà ce qui pousse les chercheurs à identifier les autres paramètres aggravants.
Des travaux ont révélé, chez 3 % des patients gravement atteints, une défaillance particulière d’origine génétique : l’impossibilité complète de produire l’interféron (voir question N).
Une faible production d’interféron est couramment observée dans la Covid-19 symptomatique. Souvent, la maladie est d’autant plus grave que l’interféron fait défaut.
Mais l’interféron peut être secrété sans pour autant être actif.
C’est le cas chez 10 % des patients gravement atteints (très majoritairement des hommes âgés). Ils synthétisent des anticorps dirigés contre l’interféron, neutralisant ainsi malheureusement son action.
L’efficacité propre de l’interféron joue également. C’est en activant certains gènes que cette molécule permet à l’organisme de s’opposer précocement à une infection virale. Parmi ceux-ci, le gène OAS (porté par le chromosome 12) intervient dans la dégradation de l’ARN viral, donc dans la destruction du programme génétique d’un virus qui vient d’infecter une cellule. Certaines personnes bénéficient d’une variante de ce gène très performante pour protéger contre les formes graves de la Covid-19, le gène OAS-1. Par son intermédiaire, l’efficacité de l’interféron est accrue. Ce gène, présent chez huit individus d’origine africaine sur dix, expliquerait que le continent africain soit beaucoup moins touché par la Covid-19.
On a découvert d’autres gènes, cette fois-ci portés par le chromosome 3, intervenant dans la réaction à la Covid. Leur origine peut paraître surprenante : c’est un héritage de l’homme de Neandertal, acquis lorsqu’Homo sapiens s’est hybridé avec Homo neanderthalensis (l’homme de Neandertal) à une période estimée à 50 0000 ans. Mais leur présence multiplie par trois le risque de développer une forme sévère de la maladie, sans qu’on en connaisse précisément la raison. Cette série défavorable est pratiquement absente en Asie du Sud-Est (Chine, Philippines, Japon). Mais elle est portée par environ 16 % des Européens, 50 % des Indiens et très répandue au Bangladesh (63 % de la population).
La génétique explique donc, en partie, les réactions différentes manifestées devant la maladie.
Enfin, 60 % des cas graves de Covid présentent une lymphopénie, c’est-à-dire une diminution considérable du nombre de certains lymphocytes T circulant dans le sang, ceux chargés d’activer d’autres cellules de l’immunité. Comme pour le VIH, le virus responsable du sida, le coronavirus entraîne le suicide cellulaire (ou apoptose) de ces lymphocytes T, infectés ou non, laissant le corps sans défense. Cette mort cellulaire programmée serait due à une activation des caspases, des enzymes responsables du processus d’apoptose. L’administration de molécules appelées inhibiteurs de caspases constitue une piste thérapeutique supplémentaire pour les patients hospitalisés.

informations mises à jour le 11/10/2022
P. Sans anticorps, notre organisme peut-il se défendre ?
Les anticorps sont, à n’en pas douter, un mode d’action clé de notre système immunitaire pour faire face aux multiples intrusions microbiennes. Pour autant, ces protéines ne sont pas nos seules forces de défense. Parmi les autres dispositifs à l’œuvre, la réponse dite cytotoxique est particulièrement importante pour lutter contre des virus et peut constituer un type de mémoire immunitaire efficace pour protéger l’organisme à plus long terme, même lorsqu’il y a très peu d’anticorps.
L’étymologie du mot le laisse entendre (« cyto » signifie cellule), la réponse cytotoxique est nocive pour certaines cellules, notamment celles qui sont infectées. Elle fait intervenir un type de globules blancs, appartenant à la famille des lymphocytes T, capables de reconnaître des cellules atypiques, comme les cellules infectées, et de provoquer leur destruction. C’est au cours d’un contact rapproché, parfois appelé « baiser de la mort », que ces lymphocytes déversent sur leur cible des granules remplis de molécules toxiques. Ce sont, par exemple, les perforines, qui percent la membrane de la cellule infectée, entraînant sa destruction par un processus de dissolution chimique appelé lyse. D’autres molécules déclenchent un programme d’autodestruction de la cellule appelé apoptose. Ce mode d’action intervient en particulier lorsqu’un virus a déjà envahi une cellule pour s’y multiplier et qu’il se trouve alors insensible à l’action des anticorps.
Notre système immunitaire déploie donc une combinaison de dispositifs complémentaires, adaptée à la nature de chaque agent pathogène, leur nombre et leur virulence. Comme pour la production d’anticorps, la réponse cytotoxique nécessite quelques jours avant d’être opérationnelle la première fois. Elle peut constituer ensuite un groupe de cellules prêtes à agir plus vite et plus efficacement en cas de réinfection par le même agent pathogène, et ce même lorsqu’il y a très peu d’anticorps. La mise en place d’une telle mémoire immunitaire est l’un des objectifs recherchés lorsque l’on met au point un vaccin contre un virus. Moins évident à détecter expérimentalement que la présence d’anticorps, le développement d’une bonne réponse cytotoxique est un enjeu manifeste face au virus SARS-CoV-2 sur lequel travaillent nombre de chercheurs.
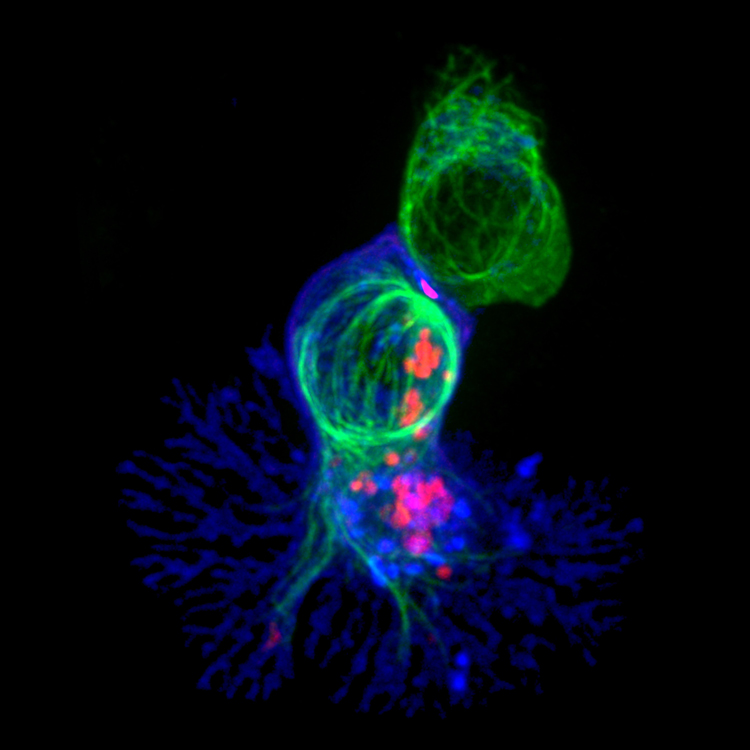
Un lymphocyte T tueur (en bleu) s'apprête à détruire sa cellule cible (en haut, en vert) grâce à des granules toxiques (rouges).

informations mises à jour le 19/02/2021
Q. Pourquoi les traitements contre les virus sont-ils très différents de ceux contre les bactéries ?
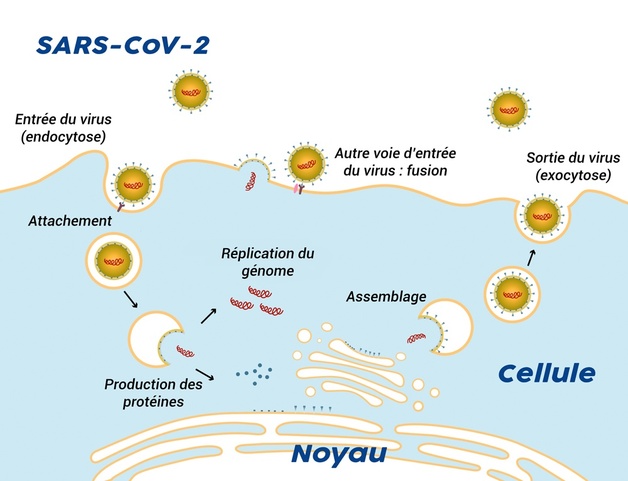
Cycle de reproduction du virus SARS-CoV-2 dans une cellule
Les bactéries sont des organismes vivants, généralement constitués d’une seule cellule. Elles possèdent les éléments nécessaires pour se nourrir, respirer et engendrer une descendance dès lors qu’elles se trouvent dans un milieu adapté. Les traitements médicaux contre les bactéries consistent donc à les empêcher de se multiplier ou à les tuer en ciblant ces éléments. C’est l’action des antibiotiques. Pour les virus, cette méthode ne fonctionne pas. En effet, les virus ne peuvent se reproduire que s’ils parviennent à pénétrer dans une cellule du corps dont ils vont monopoliser les ressources pour se répliquer. Il ne s’agit donc plus de tuer une cellule autonome mais, au contraire, de préserver une cellule hôte tout en bloquant le cycle du virus qui la parasite. Et ce n’est pas chose aisée. C’est pourquoi les traitements se limitent le plus souvent à soulager les symptômes en attendant que le virus soit éliminé par le système immunitaire. Le VIH et le virus de l’hépatite C, qui provoquent des maladies chroniques, font pourtant exception : des traitements dits « antiviraux » particulièrement efficaces ont été mis au point. Il s’agit de bloquer l’une des étapes du cycle de ces virus, dont le point commun est d’avoir un génome à ARN, molécule légèrement différente de l’ADN.
Pour les coronavirus, le cycle de reproduction débute avec la phase d’attachement. Les spicules, situés à la surface des virus, se fixent à certains récepteurs des cellules pulmonaires (voir question H). Cela déclenche l’entrée du virus (endocytose) et aboutit, notamment, à la libération de son matériel génétique à l’intérieur de la cellule. Il va alors tirer avantage des ressources à disposition dans cette dernière. On parle de détournement. Au lieu de fabriquer des éléments pour la cellule, les acteurs de celle-ci se mettent à produire deux types de protéines virales (traduction) à partir du génome ARN de l’intrus. Ces protéines sont capables de se scinder pour former de plus petites protéines ayant différents rôles (clivage). Certaines s’associent et entreprennent notamment de copier le génome viral en de multiples exemplaires. C’est la réplication. Petit à petit, tous les constituants sont produits et s’assemblent pour former de nouveaux virus qui sortent de la cellule, soit discrètement (exocytose), soit en la détruisant.
C’est pourquoi, afin de s’attaquer aux protéines virales tout en préservant la cellule hôte, la recherche d’antiviraux contre les coronavirus suit trois pistes : empêcher la phase d’attachement en ciblant le spicule, bloquer le clivage des protéines ou bloquer leur réplication.

informations mises à jour le 19/02/2021
R. Comment chercher un antiviral contre le SARS-CoV-2 ?
Concevoir un nouveau médicament est un processus très long. Face à l’urgence sanitaire liée à la Covid-19, les chercheurs du monde entier se sont tournés vers des médicaments antiviraux déjà utilisés contre d’autres pathologies. On parle de repositionnement. Mais pour l’heure, les résultats sont décevants.
Seul un antiviral utilisé contre le VIH réduit de quelques jours le temps passé à l’hôpital par les patients atteints de la Covid-19 : le remdesivir. En revanche, il ne démontre pas d’effet sur la mortalité. Ce médicament agit sur une protéine virale dont le rôle est de copier le matériel génétique du virus, nucléotide après nucléotide. Le remdesivir est un analogue de l’un de ces nucléotides, qui, une fois incorporé dans la chaîne fraîchement constituée, la bloque. La réplication du virus devrait être ainsi empêchée… mais dans le cas du SARS-CoV-2, elle est seulement réduite. Cette efficacité décevante est sans doute due à une particularité des coronavirus : ils possèdent une protéine capable de détecter et retirer les erreurs introduites dans la copie en cours de production.
Puisque les médicaments déjà connus manquent d’efficacité contre la Covid-19, il faut en concevoir de nouveaux. La méthode consiste à bien connaître les cibles susceptibles de bloquer le développement du virus (voir question Q). C’est ainsi que les chercheurs ont déterminé la structure tridimensionnelle de plusieurs protéines virales, soit la façon dont les atomes sont liés les uns aux autres dans l’espace et forment ces énormes molécules. Ils modélisent ensuite in silico, c’est-à-dire informatiquement, la fixation entre des molécules candidates et une de ces protéines virales pour choisir celles qui pourraient inhiber le mieux son activité. Ce préliminaire numérique pourrait permettre de gagner du temps dans la sélection de molécules à synthétiser et à tester ensuite in vitro et in vivo.
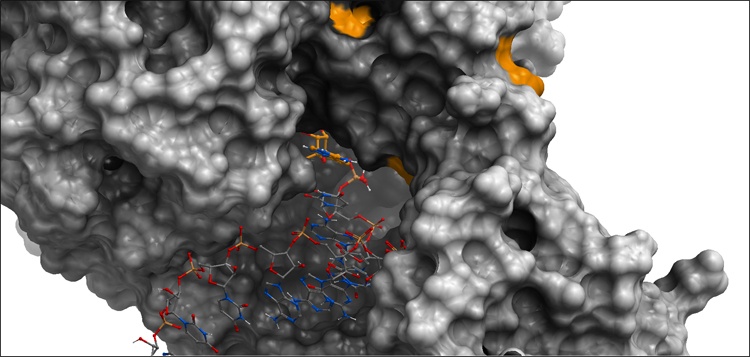
Représentation en 3D d’une protéine du SARS-CoV-2 (en gris) et du blocage de son activité par la fixation de l’antiviral remdesivir.

informations mises à jour le 19/02/2021

© Roland Seitre / Minden Pictures / Biosphoto
S. Mais où est passé le pangolin ?
L’origine du SARS-CoV-2 demeure mystérieuse. On a soupçonné le pangolin d’avoir joué le rôle d’intermédiaire permettant au virus d’infecter l’humain. Est-il toujours le principal suspect ?
96 % : c’est le taux de ressemblance entre le génome du SARS-CoV-2 et celui d’un autre coronavirus présent chez une espèce de chauve-souris vivant en Chine. Voilà qui accrédite l’hypothèse d’une émergence (voir question I), en l’occurrence le passage du virus de la chauve-souris à l’espèce humaine.
Cependant, ce virus de chauve-souris ne peut infecter directement les cellules humaines : sa protéine de surface (S) est trop différente de celle qui permet au SARS-CoV-2 de pénétrer dans nos cellules.
C’est là qu’intervient le pangolin. Car on a trouvé, chez certains spécimens, un coronavirus qui possède un gène capable de produire des protéines S très similaires à celles du SARS-CoV-2.
À partir de cette similarité, des chercheurs ont alors imaginé le scénario suivant : un pangolin porteur de ce coronavirus se retrouve également infecté par le coronavirus de la chauve-souris. Les deux virus se recombinent, prouesse courante dans cette famille de virus. Résultat : après être passé par cet animal, le nouveau virus recombiné possède le gène qui code la bonne protéine S.
Mais les ressemblances se sont révélées trompeuses.
La portion génétique du coronavirus trouvé chez le pangolin est trop différente de celle qui permet de produire la protéine du SARS-CoV-2.
Et c’est en fait un virus identique à 99 % (et non 96 %) qui pourrait accéder au titre de plus proche ancêtre du SARS-CoV-2. Les analyses de biogénétique ont montré que le virus responsable de la Covid -19 ne descend pas en droite ligne des coronavirus déjà trouvés chez la chauve-souris. Ils sont cousins, puisqu’il faut remonter au moins quarante ans en arrière pour trouver leur ancêtre commun. Et même cousins éloignés ! Le virus dont découle le SARS-CoV-2, juste avant qu’il n’infecte l’espèce humaine, est donc encore à découvrir. Et l’hôte qui l’héberge peut être un pangolin ou un tout autre mammifère.

informations mises à jour le 19/02/2021
T. Pourquoi le sida et le paludisme n’ont-ils pas leurs vaccins ?
Début de la campagne de vaccination contre la Covid-19 en Grande–Bretagne, décembre 2020
Moins d’un an après l’apparition de la maladie, plusieurs vaccins contre le SARS-CoV-2 existent. Le sida, dont le virus a été découvert en 1983, n’en a toujours pas. Le paludisme non plus. L’explication tient dans les particularités des agents infectieux responsables de ces maladies.
La mise au point d’un vaccin rencontre moins d’obstacles si le microbe varie très peu et stimule efficacement le système immunitaire. Le SARS-CoV-2 est de ceux-là, contrairement au parasite responsable du paludisme et au virus de l’immunodéficience humaine (VIH).
Le système immunitaire ne reconnaît pas un microbe dans son ensemble mais des petites parties, caractéristiques et immuables. En ciblant ces parties, il détruit le microbe. Malheureusement ces parties changent dans le virus du sida. Les erreurs se multiplient au moment de sa réplication et produisent des virus différents. Cette extrême variabilité est le principal obstacle à un vaccin qui cible un microbe précis, c’est-à-dire très peu variable. L’espoir viendra peut-être des recherches qui se focalisent sur les parties les plus stables du virus, bien que celles-ci induisent une faible réponse immunitaire.
Quant au paludisme, il est dû à un parasite qui est transmis à l’homme à l’occasion d’une piqûre de moustique. Injecté dans le sang, ce parasite infecte les cellules du foie. Après quelques jours, il infecte des globules rouges puis se retrouve dans le sang. Il peut ainsi passer à un nouveau moustique à l’occasion d’une autre piqûre. À chaque étape il se multiplie et adopte des formes très différentes. En particulier, les protéines présentes à sa surface varient beaucoup d’une phase à l’autre. Or ce sont justement ces protéines que le système immunitaire, et donc un éventuel vaccin, visent. Comme pour le sida, cette polymorphie est un écueil majeur à l’élaboration d’un vaccin.
En outre, pour le paludisme comme pour le sida, le vaccin ne devra pas mimer la réponse immunitaire mais l’améliorer. Car, pour ces deux maladies, les réactions immunitaires existent mais ne parviennent pas à éliminer les microbes.

informations mises à jour le 19/02/2021
U. Vaccin atténué, inactivé, sous-unitaire, à vecteur ou à ARN, quelles différences ?
Vacciner consiste à mettre en contact le corps avec un morceau du pathogène de façon que le système immunitaire garde une mémoire de cette rencontre et agisse rapidement et efficacement contre le microbe entier lors d’une rencontre ultérieure (voir questions F et P). Mais quel morceau choisir ? Grâce au séquençage rapide du génome du SARS-CoV-2 et aux études sur d’autres coronavirus, on a pu identifier la cible idéale. Il s’agit de la molécule de surface S, celle qui donne au virus cet aspect hérissé de piquants. L’étape suivante consiste à présenter correctement à l’organisme cette protéine S qui ne peut, à elle seule, déclencher la maladie. Pour ce faire, différentes techniques existent, chacune avec ses atouts et ses limites. En voici quelques-unes.
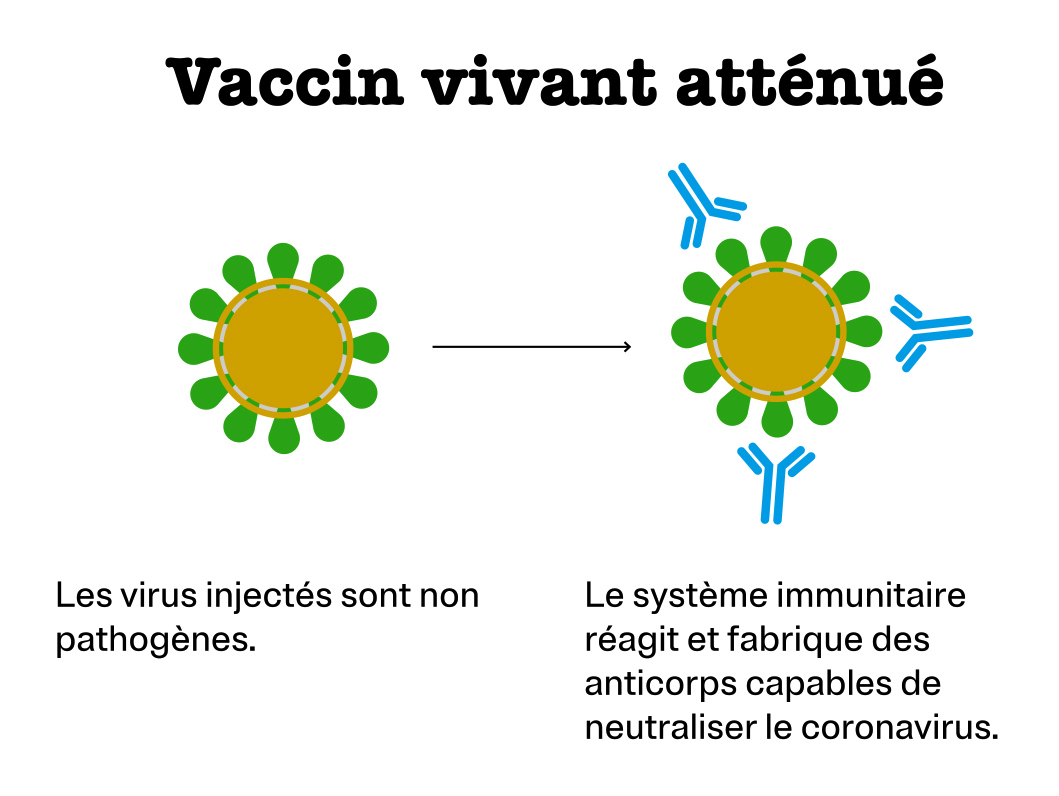
Vaccin vivant atténué
C’est l’un des plus anciens procédés. Il consiste à inoculer le microbe entier privé de son caractère pathogène. Il contient évidemment la protéine S et stimule donc le système immunitaire. Ces vaccins vivants atténués sont déconseillés aux personnes dont le système immunitaire est affaibli. Celles-ci sont en effet moins aptes à lutter contre des microbes qui bien qu’atténués se multiplient encore.
C’est le principe du vaccin combiné contre les trois infections rougeole, oreillons et rubéole (ROR).
Société mettant au point un vaccin de ce type contre la Covid-19 : Codagenix, associée au Serum Institute of India.
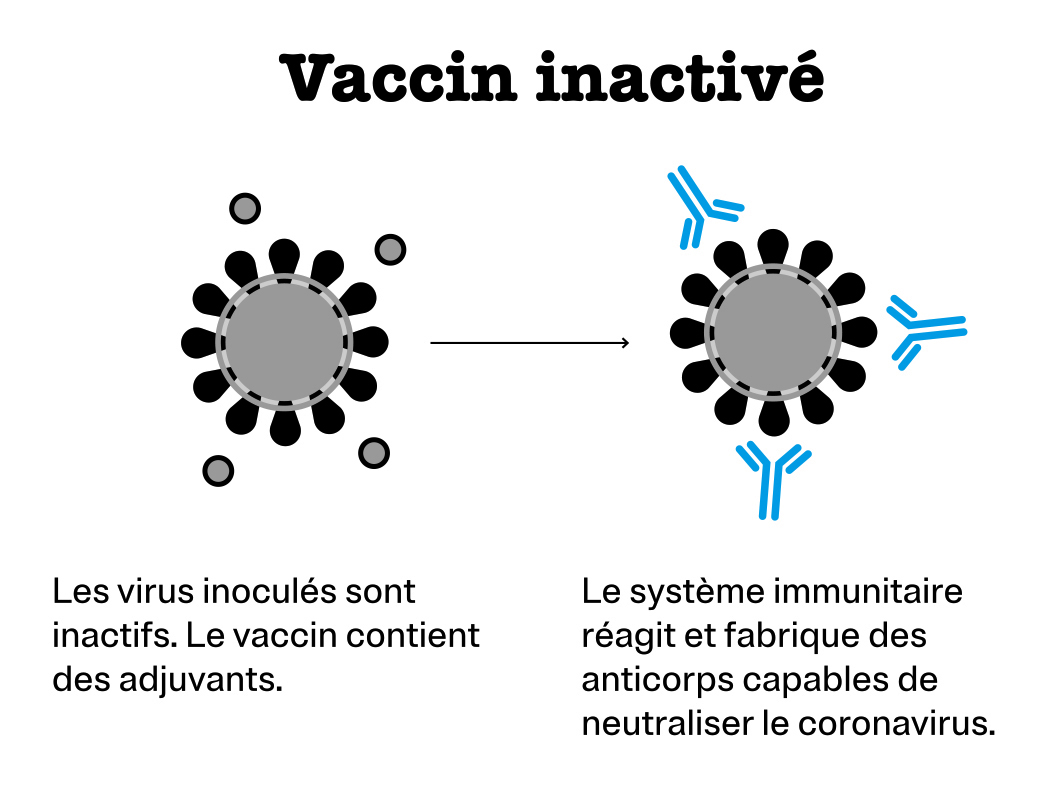
Vaccin inactivé
Cette fois, l’agent infectieux est incapable d’engendrer des symptômes et de se multiplier. Bien toléré chez des personnes immunodéprimées, cette vaccination mime moins bien l’infection. L’immunité est moins performante. Voilà pourquoi plusieurs injections – ou rappels – sont nécessaires. L’ajout d’un adjuvant dans la composition vaccinale permet de compenser la moindre activation de nos défenses.
C’est le principe du vaccin contre la poliomyélite.
Sociétés mettant au point un vaccin de ce type contre la Covid-19 : Sinovac Biotech d’une part et Beijing Biological Products Institute d’autre part.
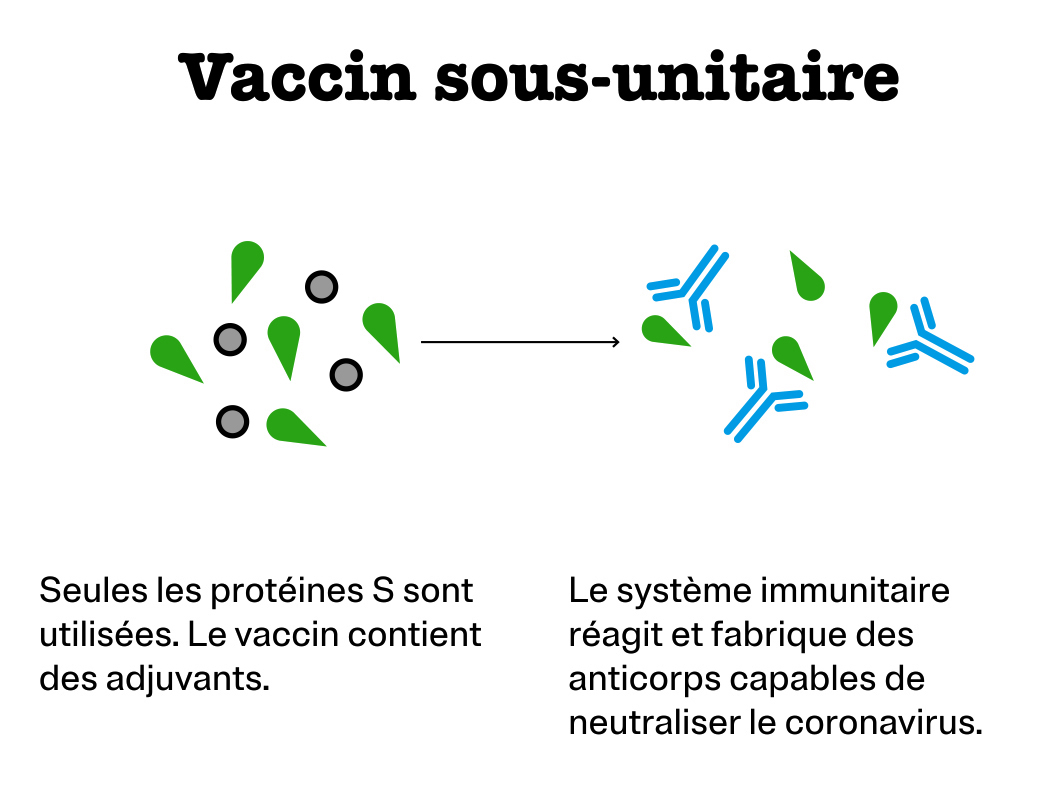
Vaccin sous-unitaire
Il s’agit d’injecter uniquement l’antigène cible. On inocule donc la protéine S ou une partie de cette protéine, synthétisée en laboratoire. C’est la technique la plus utilisée dans les différents essais de vaccin contre la Covid-19. Elle est réputée d’autant plus sûre qu’elle ne comporte pas le virus entier. Mais elle nécessite l’ajout d’adjuvants dans le vaccin pour que le système immunitaire réagisse.
C’est le principe des vaccins contre la coqueluche, la méningite à méningocoque et l’hépatite B.
Sociétés mettant au point un vaccin de ce type contre la Covid-19 : Novavax d’une part et Sanofi Pasteur associé à GlaxoSmithKline (GSK) d’autre part.
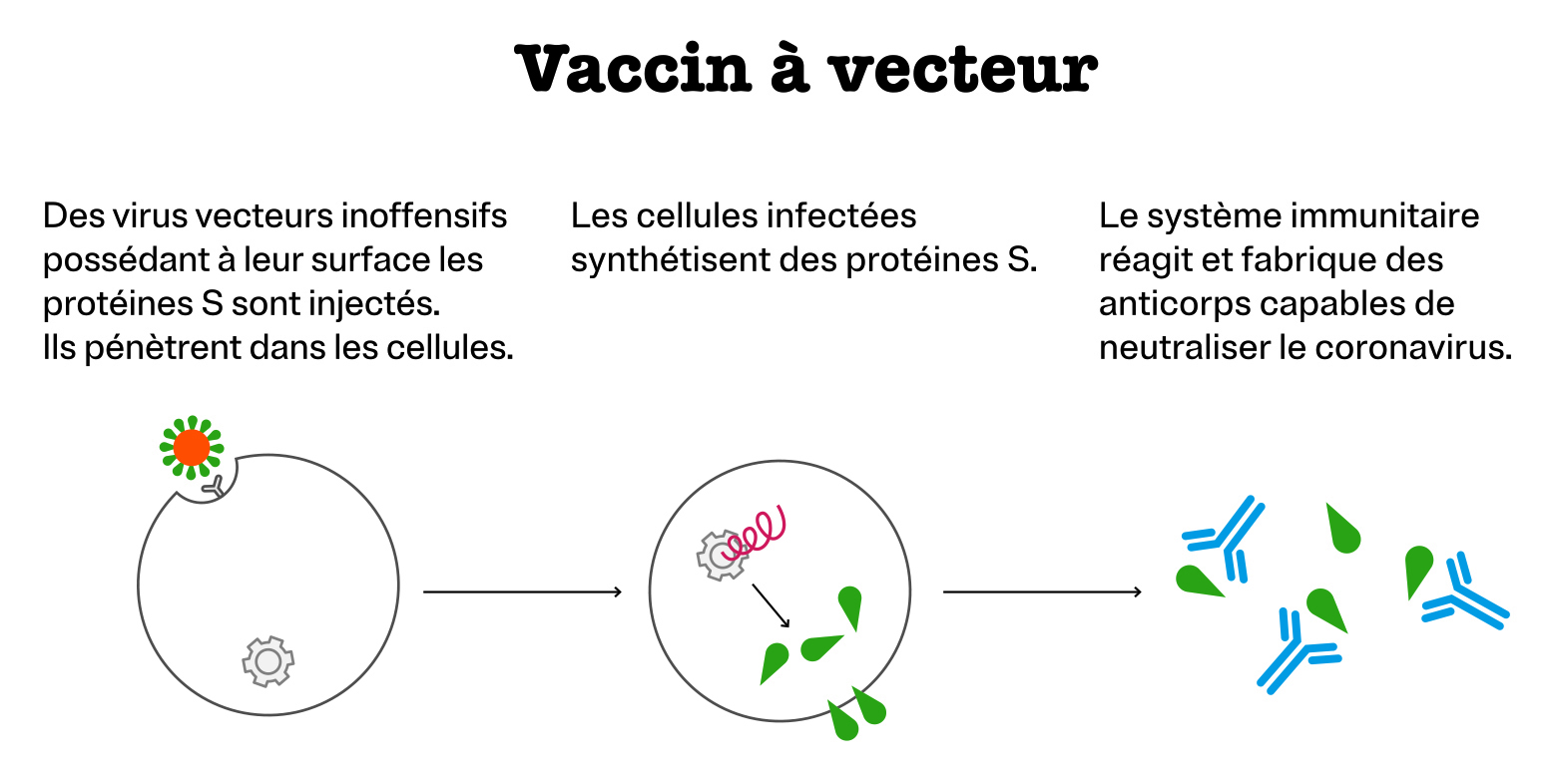
Vaccin à vecteur
Au lieu d’introduire directement la protéine S, cette méthode consiste à modifier un virus inoffensif pour l’homme de façon que sa surface comporte des protéines S. Ce virus joue le rôle d’un transporteur, on parle de vecteur viral. En transportant la protéine S dans l’organisme, il déclenche contre elle une réponse immunitaire.
C’est le principe du vaccin contre Ebola.
Sociétés mettant au point un vaccin de ce type contre la Covid-19 : AstraZeneca d’une part et CanSino Biologics associé à Beijing Institute of Biotechnology d’autre part.
Vaccin à ARN
Le principe est ici de faire produire des protéines S par nos propres cellules. Pour ce faire, le vaccin contient une molécule appelée ARN messager (ARNm), enfermée dans une petite vésicule constituée de lipides. Après injection, celle-ci fusionne avec la membrane des cellules et y libère l’ARNm. Une machinerie présente naturellement dans les cellules suit alors les instructions contenues dans l’ARNm et produit des protéines S, mais de manière transitoire, car l’ARNm est une molécule qui se dégrade rapidement. Outre la rapidité et une certaine simplicité de fabrication, ce type de vaccin ne nécessite pas l’ajout d’adjuvant car la molécule d’ARNm joue elle-même ce rôle permettant la mise en place d’une réponse immunitaire forte et spécifique.
Aucun vaccin de ce genre n’était utilisé auparavant.
Sociétés mettant au point un vaccin de ce type contre la Covid-19 : Pfizer et BioNTech d’une part et Moderna d’autre part.
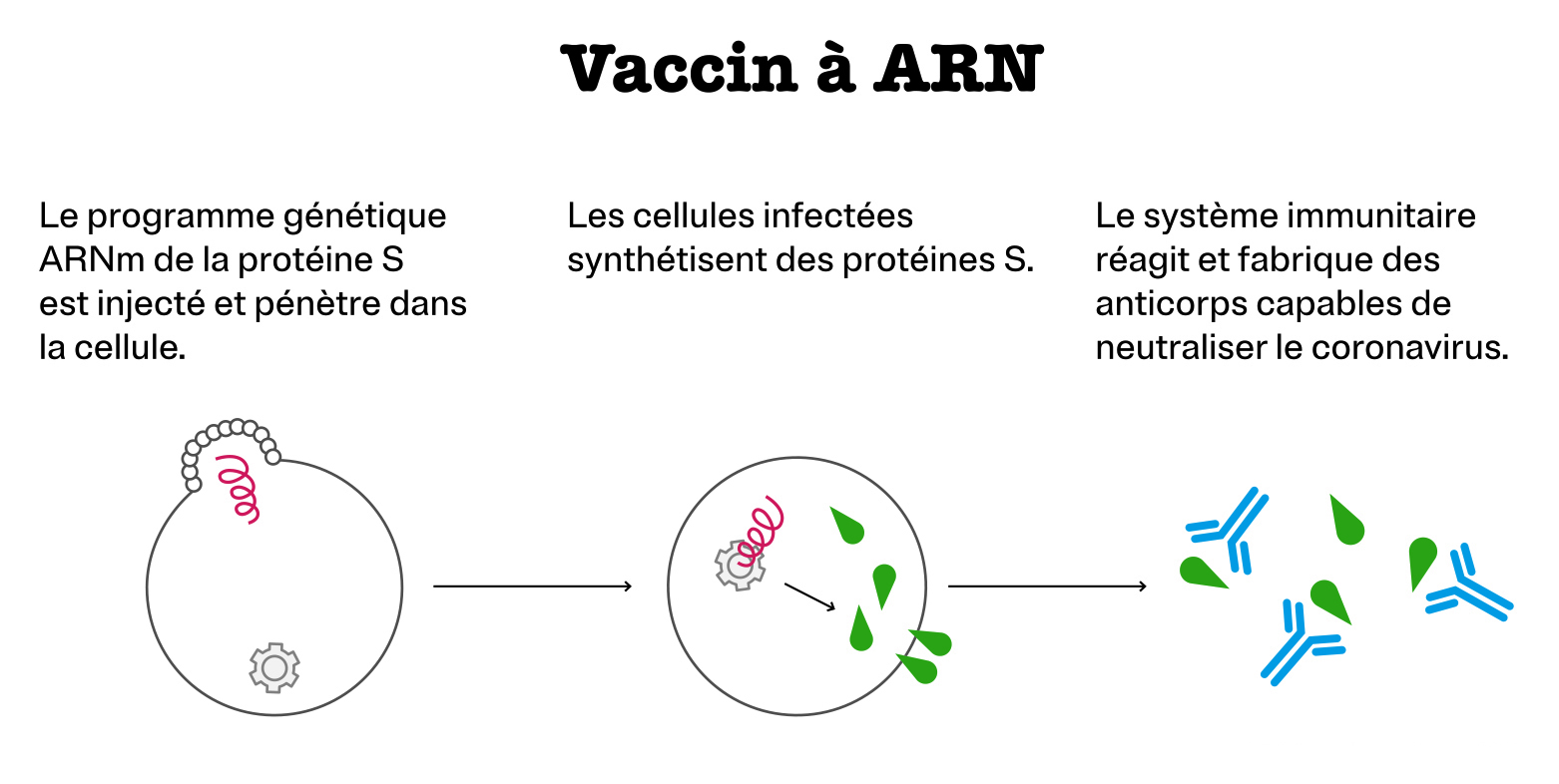

informations mises à jour le 19/02/2021
V. D’où viennent les variants ?
Evolution génétique du virus SARS-CoV-2 entre décembre 2019 et avril 2021 en Europe : un variant unique semble être à l’origine de l’épidémie en Europe et l’automne 2020 est marqué par l’expansion du variant britannique (en orange foncé, V1).
Variants anglais, sud-africain, brésilien, japonais, américain… si une nomenclature scientifique est préférable, la multiplication récente de ces appellations suggère une diversité croissante au sein de la population des virus SARS-CoV-2 en circulation. La souche virale qui a frappé l’Europe début 2020 était elle-même un variant de la souche majoritaire qui circulait alors en Chine. Une telle hétérogénéité n’est en réalité pas inattendue, et les virus à ARN sont même réputés pour cela.
Un virus se multiplie au sein d’un hôte. Au cours de la phase aiguë d’une maladie, ce sont ainsi des milliards de virus qui sont produits, et tous ne sont pas identiques. En effet, la réplication, c’est-à-dire la copie du génome viral en de multiples exemplaires, est un processus relativement imprécis chez les virus à ARN. L’enzyme virale qui effectue ces copies y inclut aléatoirement des erreurs. Ces modifications de l’information génétique sont appelées des mutations. Même si les coronavirus ont un système de relecture pour limiter les erreurs de copie, le phénomène reste fréquent. Néanmoins, la plupart de ces virus mutants sont amenés à disparaître parce que les erreurs qui surviennent leur sont fatales. D’autres possèdent des mutations dites neutres, car elles ne changent en rien leurs caractéristiques. Certaines d’entre elles pourront d’ailleurs s’éteindre dans les générations suivantes ou persister au hasard des événements. Enfin, quelques mutations s’imposent parce qu’elles apportent un avantage aux virus qui les portent.
À un instant donné, plusieurs souches virales peuvent donc coexister au sein d’un même hôte. L’une d’entre elles est souvent majoritaire ou peut le devenir par hasard ou par gain, par exemple si elle a la capacité de se répliquer plus efficacement que les autres. Mais cet avantage du mutant au sein d’un hôte avec ses défenses immunitaires, ses traitements médicaux spécifiques, n’en est pas nécessairement un dans l’ensemble de la population. Pour devenir dominant, le mutant devra bénéficier soit d’un avantage au sein de la population, soit d’un hasard qui rendra sa dissémination favorable. Ce peut être le cas lors d’un grand rassemblement dans un lieu peu aéré. On estime que ce phénomène de sélection a abouti à la fixation d’une ou deux mutations par mois chez le SARS-CoV-2 depuis le début de l’épidémie.
Les variants de l’automne 2020 seraient apparus progressivement à l’abri des radars de nos séquenceurs. Ils interpellent car chacun possède un nombre élevé de mutations et que celles-ci sont similaires. Elles ont émergé en différents endroits du globe, indépendamment, prenant un avantage dans leurs environnements respectifs. On parle de convergence. Et ce sont souvent les conséquences visibles de ces mutations à l’échelle de la population qui font prendre conscience de l’apparition d’un variant : un résultat PCR nouveau, une propagation accrue, des cas de réinfection, une nouvelle population cible, une résistance inédite au vaccin ou aux traitements existants ou encore des symptômes différents, par exemple un virus qui gagne ou perd en agressivité.

informations mises à jour le 14/05/2021
W. Que sont ces variants du SARS-CoV-2 ?
Chez les virus à ARN comme le SARS-CoV-2 mais aussi la grippe ou l’hépatite C, l’apparition de variants est un phénomène relativement fréquent. Ce phénomène discret nous est révélé quand le mutant en question modifie un paramètre fondamental de la maladie ou de l’épidémie. C’est ce qui frappe le monde en divers endroits depuis l’automne 2020.
Le comportement et la structure du SARS-CoV-2 dépendent des 20 protéines qui le constituent. Ces protéines sont produites par nos cellules infectées lors du cycle du virus, à partir des informations génétiques contenues dans l’ARN de ce dernier. Pour identifier l’existence d’un variant, il faut donc examiner cet ARN, et plus précisément l’ordre de succession des 30 000 bases qui le composent. Cette analyse s’appelle un séquençage. Beaucoup de variations d’ARN n’entraînent pas de modification notable dans le fonctionnement du virus. D’autres, au contraire, provoquent des changements d’ordre clinique et épidémiologique, par exemple une contagiosité différente, une virulence inédite ou des symptômes particuliers. Un mutant accède au rang de variant s’il présente des changements remarquables d’une ou plusieurs de ces caractéristiques d’intérêt.
Les mutations favorables au virus sont de deux ordres. Celles influençant sa capacité à infecter les cellules humaines et celles lui permettant de contourner le système immunitaire. Le spicule est partie prenante dans ces deux volets. Il intervient dans l’attachement du virus (voir question H). Il est la cible de nombreux anticorps. Sans surprise, les mutations améliorant la compétitivité du virus touchent cette grande protéine.
En avril 2020, une première mutation a émergé : D614G. Elle est rapidement devenue dominante et est toujours présente. Sans surprise, elle touche la protéine de pointe. Sa présence facilite l’arrimage du virus à une cellule. Plus précisément, D614G est caractérisée par le remplacement du 614ème acide aminé de cette protéine qui en compte 1273 : l’acide aspartique (D) laisse la place à une glycine (G).
D’autres mutations se sont ajoutées. La mutation N501Y correspond au remplacement d’un acide aminé tyrosine (Y) à la place d’une asparagine (N) en position 501. Celle-ci aussi favorise l’arrimage aux cellules. Puis la mutation E484K, où un acide glutamique (E) laisse sa place à une lysine (K). Elle est localisée dans une région en forme de crête à la surface du spicule, une zone reconnue par certains anticorps neutralisants en lutte contre le virus (voir figure).
Alpha, Béta, Delta, Omicron bénéficient de ces trois mutations… et d’autres. Car chaque variant possède une combinaison particulière de mutations dont certaines sont communes et d’autres originales.
En janvier 2022, le variant Omicron a pris le pas sur le variant Delta en Europe. Il porte un spicule profondément modifié par rapport au spicule du SARS-CoV-2 de référence, celui isolé à Wuhan (Chine) en 2019. Trente-deux mutations expliquent les modifications de certains acides aminés dans cette protéine de pointe. À comparer avec celle du variant précédent, le variant Delta, qui en comptait quinze. Le résultat est une amélioration de la capacité à se propager. Delta était deux fois plus transmissible que la souche originelle. Omicron l’est trois fois plus. Quant à ses sous-variants, leur contagiosité est encore plus forte.
En mai 2022, BA.2 est le sous-variant dominant en France : c’est donc lui qui a la capacité de se transmettre la plus élevée.
Mais, au début de l’été 2022, deux autres se sont imposés : BA.4 et BA.5. Ils possèdent une mutation leur permettant d’échapper aux anticorps générés par une précédente infection. Grâce à elle, ces variétés de SARS-CoV-2 réinfectent plus facilement les personnes guéries.
Toutes les mutations ne modifient pas les caractéristiques d’un virus. Et le SARS-CoV-2 ne peut pas se transformer indéfiniment. Il arrivera un moment où il épuisera son potentiel évolutif, c’est-à-dire que les mutations n’auront plus de grands effets sur ces caractéristiques. Reste à savoir quand !


informations mises à jour le 13/10/2022
X. Vaccin à ARN : de l’idée à la production
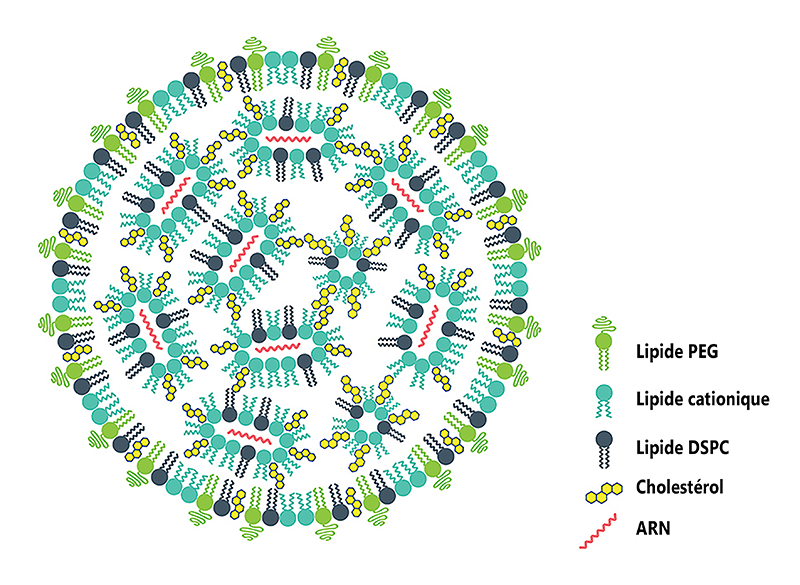
Structure d’une nanocapsule
Lipide PEG : empêche les nanocaspsules de fusionner entre elles.
Lipide cationique : il est chargé positivement et fixe l’ARN qui qui a une charge négative. Une fois dans la cellule, ce lipide libère l’ARN.
Lipide DSPC : permet à la nanocapsule de conserver sa forme.
Cholestérol : assure la mobilité des composants entre eux.
ARN : contient le programme génétique de la spicule S.
L’idée date de 1990. Trente ans – et une pandémie – plus tard, des vaccins à ARN sont produits en quantité contre la Covid-19. Des usines tournent à plein et toute une chaîne de fournisseurs hyperspécialisés est mobilisée.
La fabrication industrielle du vaccin à ARN s’échelonne en quatre étapes. La première est la multiplication de brins… d’ADN ! Car pour obtenir l’ARN, l’industrie reproduit le procédé naturel de fabrication de cette molécule. Et les cellules synthétisent l’ARN en suivant les instructions des molécules d’ADN.
Le premier pas est donc l’obtention de molécules d’ADN en grande quantité. Chaque brin d’ADN modèle est introduit dans des bactéries Escherichia coli. Placées dans un fermenteur, les bactéries se multiplient pendant quatre jours. Puis elles sont détruites et des milliards de brins d’ADN modèles sont récupérés.
L’étape suivante est la transcription de l’ADN en ARN, c’est-à-dire la copie de l’ADN en ARN. Ce processus biologique, qui se déroule dans une cuve métallique de quelques dizaines de litres, prend deux heures. Chaque molécule d’ADN est transcrite des dizaines de fois et peut engendrer jusqu’à 500 brins d’ARN. Puis les molécules d’ADN sont dégradées. Et finalement, les molécules d’ARN désirées sont séparées notamment grâce à leurs particularités électriques : elles ont une charge négative.
L’ARN doit être ensuite enveloppé dans une capsule de lipides. C’est le moment le plus délicat, mais il est indispensable puisqu’il limite la dégradation de la molécule d’ARN et lui permet de passer à travers la membrane des cellules humaines quand le vaccin est injecté (voir question U). Quatre lipides différents entrent dans la composition des capsules. Deux leur confèrent une composition analogue à celle d’une membrane cellulaire. Le troisième est un lipide chargé positivement. Le quatrième stabilise l’ensemble. Quand les graisses sont projetées sous forme de microgouttelettes en direction de microquantités d’ARN, elles s’assemblent à celles-ci en une nanoseconde grâce à l’attraction entre les charges électriques opposées. On obtient ainsi des nanocapsules d’ARN entourées de lipides (voir figure).
La dernière étape est le remplissage des flacons. Les nanocapsules sont diluées dans un milieu liquide, dont la composition garantit un pH neutre et stable, auquel on ajoute du saccharose. Le saccharose évite la formation de cristaux de glace. Car une fois remplis, les flacons sont rapidement congelés.
Un flacon de vaccin nécessite deux mois de fabrication. Les tests de qualité occupent une grande partie de ce temps. Il contient presque 300 composants différents. Certains sont courants, comme le saccharose. Mais la plupart sont la spécialité d’une poignée de sociétés dans le monde. Avant la pandémie, ils étaient produits en quantité confidentielle. Le lipide chargé positivement est l’un d’entre eux. Sa synthèse, uniquement maitrisée par quatre sociétés, demande plusieurs semaines.
À ce jour, des dizaines d’entreprises sont impliquées dans la fabrication des vaccins à ARN. Cette production, complexe à mettre en place mobilise des industries aux USA, au Canada, en Suisse, en Allemagne, en Belgique, en France, en Chine. Des milliards de doses sont, en effet, attendues.

informations mises à jour le 16/07/2021
Y. Pourquoi une personne vaccinée peut-elle encore transmettre le virus ?
La vaccination contre le SARS-CoV-2 débouche sur la synthèse durable d’anticorps neutralisant le virus. Mais le mode d’administration pour prévenir cette infection respiratoire – une piqûre dans un muscle de l’épaule – présente un inconvénient. Malgré la vaccination, les voies aériennes supérieures (bouche, nez, larynx) interceptent mal le virus au moment de son entrée.
Suite à une infection naturelle par le SARS-CoV-2, plusieurs catégories d’anticorps (ou immunoglobulines, ou Ig) sont détectables (A), que l’on ait été malade ou pas. Les anticorps sont des molécules produites par certaines cellules de l’immunité et qui préviennent une nouvelle infection.
Après une vaccination par injection intramusculaire, l’une de ces catégories est absente, celle des IgA. Quand ils sont présents, ces anticorps éliminent le virus dès son entrée dans les voies aériennes. Les IgA se trouvent, en effet, à la surface des membranes qui tapissent l’intérieur du nez, de la bouche et du larynx. Mais leur synthèse nécessite la rencontre de certaines cellules immunitaires de ces membranes avec le virus, ce qui n’a pas lieu avec une injection intradermique dans l’épaule.
En revanche la piqûre déclenche bien, et pour une longue durée, la synthèse d’autres anticorps, les IgG (B). Ceux-là sont présents dans le sang et dans la lymphe. Certains passent à l’intérieur des alvéoles pulmonaires et protègent les poumons. Ils évitent cet emballement de l’inflammation, typique du SARS-CoV-2, à l’origine des cas graves. En abaissant la charge virale de l’organisme, ils diminuent aussi notablement les risques de transmission. Ainsi, une personne vaccinée et infectée est à la fois immunisée(1) et, à un degré moindre qu’une personne non vaccinée toutefois, contagieuse.
L’administration d’un vaccin sous forme de spray dans le nez pourrait régler le problème (C). Cette technique vise à stimuler les cellules immunitaires des muqueuses respiratoires en leur présentant la protéine S. Plusieurs types de vaccins nasaux sont à l’étude. Ils emploient des virus atténués, des virus vecteurs portant la protéine S ou la seule protéine S. Ils ne s’appuient pas sur la technologie de l’ARN messager.
(1) 92 % de protection contre les formes graves de la maladie, sept jours au moins après la troisième injection.
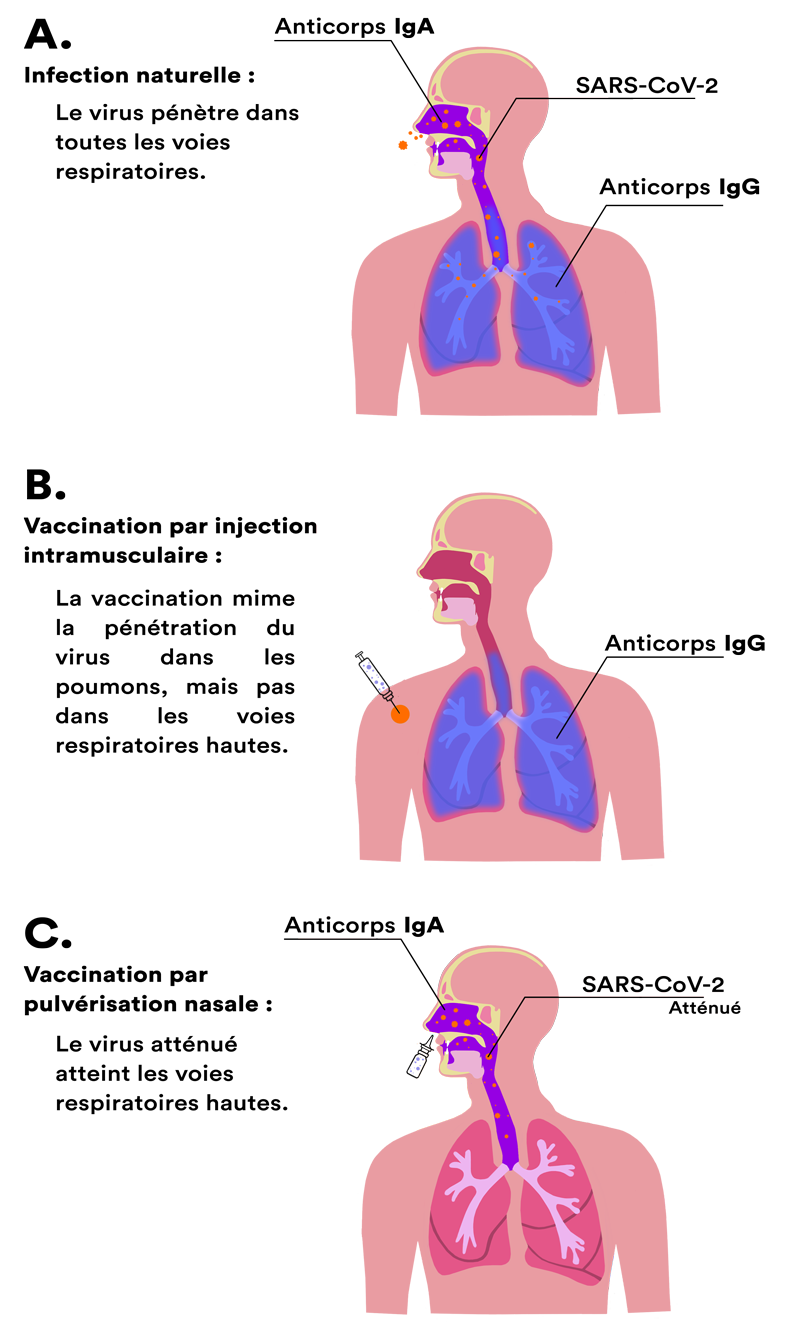
Synthèse des anticorps dans l’arbre respiratoire.
- Après une infection naturelle, des anticorps s’installent dans la totalité des voies respiratoires.
- Après une vaccination intramusculaire, ils sont présents uniquement dans les poumons.
- La vaccination par pulvérisation nasale déclenche leur synthèse surtout dans les voies respiratoires supérieures.

informations mises à jour le 13/01/2022
Z. Pourquoi avons-nous besoin de rappels ?

Plasmocytes secrétant des anticorps (mille par seconde). Image de synthèse.
Plus rapide, plus intense, plus adapté. En un mot, plus efficace. Le système immunitaire s’améliore face à un microbe après une première rencontre, naturelle ou vaccinale, avec ce même microbe. Éduqué, il se trouve apte à contrer une réinfection. Mais, avec le temps, ses nouvelles capacités s’amenuisent. Un rappel vaccinal est destiné à les maintenir, en assurant la présence de cellules particulières : les cellules mémoires.
La première rencontre avec un agent infectieux aboutit à la synthèse par le système immunitaire de molécules capables de détruire ce microbe, les anticorps. Nombreux pendant l’infection, leur taux s’effondre ensuite. Dans le cas du SARS-CoV-2, il chute de 80 à 90 % quatre mois après une infection naturelle, puis se stabilise. Les anticorps demeurent détectables dans le sang plusieurs mois durant. Un cas intéressant est celui des vaccinés contre la variole, chez lesquels les anticorps dirigés contre ce virus sont détectables à vie. Pourtant, individuellement, les anticorps ont une existence courte : seulement quelques jours. Leur persistance s’explique par leur renouvellement permanent, dû à un stock important de cellules qui les produisent en permanence : les plasmocytes. Ces plasmocytes se sont mis en place à la suite de la vaccination ou de l’infection par un microbe.
Ils vivent longtemps. Au moins un an dans le cas du SARS-CoV-2. Et s’ils disparaissent, une réserve de cellules particulières, les lymphocytes B mémoires, les remplace. Grâce à cette réserve, le système immunitaire conserve une capacité de réaction rapide.
Mais la réponse immunitaire ne se cantonne pas à une réaction par des anticorps. Des cellules dites tueuses – parce qu’elles détruisent les cellules infectées par le virus – agissent également. Difficile à détecter, leur activité est néanmoins cruciale pour étouffer une infection. Là aussi, la première contamination enrayée, une réserve de ces cellules tueuses demeure. Elles sont qualifiées de cellules tueuses mémoires. Elles répondront rapidement en cas de réinfection. Cette réserve peut décroître. Six mois après une infection naturelle au SARS-CoV-2, elle diminue de moitié. Et, là encore, les rappels ont pour but de la maintenir.

informations mises à jour le 13/01/2022
29. Qu’est-ce-que le Covid long ?
La difficulté à se remettre de la Covid est qualifiée de Covid long. Elle touche tous les continents, toutes les populations et concerne tous les âges.
Quatre semaines après l’apparition des symptômes, le virus ne se réplique plus dans les poumons. Des traces peuvent être trouvées dans les vingt jours suivants. Puis, dans la très grande majorité des cas, plus rien. Et pourtant, au moins 10 % des personnes ayant déclaré la maladie subissent un contrecoup qui se prolonge au-delà de trois mois. Elles souffrent de plusieurs symptômes, également notés après une infection avec deux autres coronavirus : le SARS-CoV-1 et le MERS-CoV (syndrome respiratoire du Moyen-Orient), apparus respectivement en 2003 et 2012. Les plus courants sont une respiration difficile, des troubles du sommeil, mais aussi des douleurs thoraciques, des palpitations cardiaques, et la perte du goût et de l’odorat. Dans ces conditions, on comprend que la faiblesse extrême et la dépression soient générales chez ces patients.
L’infection par le SARS-CoV-2 – et non la vaccination – est bien à l’origine de cette difficile convalescence. Ce virus est capable d’affecter et d’affaiblir beaucoup d’organes différents : les poumons comme le cœur, les reins, les vaisseaux sanguins et le cerveau. Cette attaque tous azimuts est sans doute une des causes de la variété des symptômes observés.
Le plus répandu est une diminution de l’efficacité pulmonaire. La paroi des alvéoles pulmonaires, devenue fibreuse, freine la diffusion de l’oxygène dans le sang. La moitié des malades souffrant d’un Covid long éprouve des difficultés à respirer. Au point que 6 % d’entre eux ont besoin d’oxygène supplémentaire. Quant à la survenue de thromboses et de palpitations cardiaques, on privilégie pour les expliquer la persistance d’une inflammation résiduelle dans le cœur et la paroi des vaisseaux sanguins. Dans le cerveau, l’inflammation des micro-vaisseaux va jusqu’à toucher les cellules chargées de nourrir les neurones. La déficience de ces cellules provoquerait fatigue et confusion mentale.
D’autres causes sont suspectées. La première d’entre elles est la persistance du virus, liée à sa très large dissémination dans le corps. On sait aussi qu’il perturbe le fonctionnement des mitochondries, ces éléments présents dans les cellules et qui leur fournissent l’énergie. La maladie a-t-elle mis au jour des problèmes auparavant méconnus ? A-t-elle réveillé le virus de la mononucléose, souvent impliqué dans un syndrome de fatigue chronique ? Existe-t-il des facteurs prédisposant au Covid long tels que l’anxiété et la dépression ?
Aujourd’hui, pour des millions de personnes dans le monde, la Covid-19 ne se termine pas après l’élimination du virus. Et, si avoir souffert d’une Covid aiguë prédispose à une sortie difficile de la maladie, avoir ressenti une Covid bénigne, voire asymptomatique, ne garantit pas d’échapper au Covid long. Heureusement, la plupart des symptômes s’estompent au fil du temps. Mais cinq mois après avoir contracté le virus, à peine la moitié des patients dit avoir récupéré.

informations mises à jour le 13/10/2022

Les médecins reçoivent de nombreux patients se plaignant de symptômes longtemps après avoir déclaré la Covid-19.

La protéine S d’un virus SARS-CoV-2 (en rouge) est la cible d’anticorps différents. Parmi eux, les anticorps se fixant au domaine de liaison et ceux se liant au domaine N-terminal (NTD) sont neutralisants.

informations mises à jour le 13/10/2022
30. Comment les anticorps luttent-ils contre le SARS-CoV-2 ?
Le mode d’action des anticorps est plus large qu’on ne l’imagine. Et ceux dirigés contre le SARS-CoV-2 n’échappent pas à cette diversité.
L’action la plus connue des anticorps est leur fixation sur le virus, plus précisément leur attachement au domaine de liaison au récepteur de la protéine S. Le domaine de liaison, ou RBD (receptor binding domain), est la région du spicule qui se lie aux récepteurs ACE2 de la cellule et permet l’entrée de la particule virale (voir question H). Les anticorps qui se fixent au RBD sont dits neutralisants : ils neutralisent l’effet du virus en l’empêchant de pénétrer dans les cellules pour s’y multiplier.
Mais dans les faits, 80 % des anticorps ciblent un autre endroit que le RBD, tel que le domaine N-terminal ou NTD (voir illustration). Beaucoup restent efficaces, d’autres sont alors sans effet : ils sont non neutralisants.
Mais l’action des anticorps ne se borne pas à recouvrir le virus pour l’empêcher d’entrer dans une cellule. Ils sont également actifs dans sa destruction.Une fois fixés sur le virus, ils peuvent déclencher sa phagocytose (absorption par des globules blancs). Ils peuvent également activer des protéines dissoutes dans le sang, dont l’effet est la destruction de l’enveloppe des virus. Enfin, ces mêmes anticorps sont capables d’agir en mobilisant des cellules particulières, les cellules dites NK, qui détruisent les cellules infectées par le virus. Toutes ces actions, encore en cours d’étude dans la Covid, jouent sans doute un rôle crucial pour lutter contre le SARS-CoV-2.
Une autre facette des anticorps était redoutée au début de la pandémie. Il s’agit du pouvoir facilitateur de certains d’entre eux qui, loin d’enrayer l’infection, la servent en provoquant l’entrée de virus dans certains globules blancs. Bien connue dans le cas de la dengue, cette éventualité est aujourd’hui considérée comme négligeable pour la Covid.
À la variété des rôles, s’ajoute l’évolution de la population d’anticorps. Les premiers anticorps à circuler sont bien différents de ceux présents trois mois plus tard. Ils sont peu puissants car l’affinité avec leur cible est faible. Mais après un rappel ou une réinfection, les nouveaux anticorps produits sont hyper efficaces contre ce même virus. Leur apparition montre la capacité d’apprentissage de notre système immunitaire.

© Photo12 / Alamy / Xan Gasalla
31. Quels sont les effets secondaires des vaccins contre la Covid-19?
Les premières vaccinations contre la Covid-19 ont commencé au début de l’année 2021. Douze mois plus tard, 10 milliards d‘injections avaient été réalisées. L’importance de ce nombre a permis de révéler des effets secondaires rares et très majoritairement légers.
Les myocardites en font partie. Statistiquement, cette inflammation du muscle cardiaque est déclenchée par la vaccination chez deux vaccinés sur 100 000. Seuls les vaccins à ARN messager (BioNTech - Pfizer et Spikevax, de Moderna - NIAID) sont mis en cause. Cet effet secondaire touche essentiellement les jeunes hommes (moins de 30 ans) et se révèle en général dans la semaine suivant la deuxième injection. Le plus souvent, il se résorbe de lui-même en quelque jours.
La vaccination contre la Covid-19 est également impliquée dans des complications de la coagulation sanguine (thrombose). Plus précisément une thrombose particulière, qui survient dans des veines qui drainent le sang du cerveau. Le taux d’incidence est très faible (0,1 cas sur 100 000 vaccinés) mais la complication peut être fatale. Ici, c’est la vaccination à adénovirus (vaccins Oxford - Astra Zeneca et Johnson & Johnson - Janssen) qui est pointée du doigt. Les personnes touchées étant jeunes, ces deux vaccins sont interdits aux moins de 55 ans.
Trouble de la coagulation et myocardite sont des effets secondaires sérieux, mais il ne faut pas perdre de vue qu’ils sont beaucoup plus courants et intenses pendant la maladie. Sur 100 000 personnes atteintes par le virus, et non vaccinées, 200 rencontrent ces problèmes, avec des formes sévères et parfois fatales.
Le zona et la perturbation du cycle menstruel sont également sous surveillance. Le premier est provoqué par la réactivation du virus de la varicelle. Moins d’un cas pour 100 000 vaccinés semble provoqué par la vaccination. Quant au cycle menstruel, celui qui suit la vaccination est parfois plus long, en moyenne de moins d’un jour. L’augmentation du flux sanguin est également signalée. Mais ces symptômes disparaissent durant les cycles suivants et n’ont aucune incidence sur la fertilité.
À ces effets secondaires s’ajoutent les classiques maux de tête, fatigue, épisodes fiévreux, qui sont des réactions courantes après toute vaccination. Tout comme le gonflement des ganglions lymphatiques, qui indique l’activation du système immunitaire. En général, ces contrecoups sont bénins et brefs. Et, la balance bénéfices/risques est incontestablement en faveur de la vaccination, qui montre un important niveau de protection contre les formes graves ou mortelles de la maladie.
Pour beaucoup, la question est de savoir si des conséquences inattendues se révèleront à long terme. Peut-être… Cependant il n’y a pas d’exemple de vaccin chez lequel des effets secondaires soient apparus un an ou plus après l’injection.

informations mises à jour le 13/10/2022



