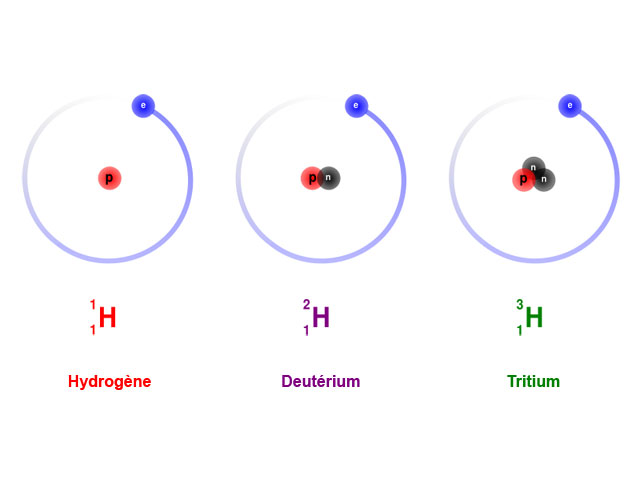
Le tritium, un isotope de l'hydrogène
Chaque élément chimique est défini par le nombre de protons dans son noyau. Mais le nombre de neutrons du noyau peut varier. Deux atomes ayant le même nombre de protons mais un nombre différent de neutrons sont appelés des isotopes. Ils ont les mêmes propriétés chimiques, mais leur masse diffère légèrement. Pour un même élément, certains isotopes sont radioactifs et d'autres stables. Ainsi, le carbone-12 (près de 99 % du carbone sur Terre), dont le noyau possède 6 protons et 6 neutrons, est stable, tandis que le carbone-14, qui possède 6 protons et 8 neutrons, est radioactif, et utilisé pour la datation d'objets. L'hydrogène, quant à lui, existe sous trois formes : l'hydrogène-1, le plus abondant, est stable, de même que l'hydrogène-2 appelé deutérium. En revanche, l'hydrogène-3, appelé tritium, est radioactif et se désintègre en émettant un électron. Il est produit par les activités nucléaires, mais il existe aussi à l'état naturel.
© DR