La médecine prédictive, pour quoi faire ?
Qu’entend-on par médecine prédictive ?
Face à la maladie et à la mort, les sociétés humaines ont toujours cherché à prédire le futur, diminuer l'incertitude et infléchir le cours du destin. Que l'on utilise des astres, des cartes, un pendule ou des moyens d'investigation scientifiques ultrasophistiqués, la quête peut sembler identique. Preuve que la démarche prédictive n'est pas l'apanage de la médecine moderne. Cependant, l'utilisation de marqueurs biologiques, et notamment des premiers tests génétiques dès les années 80, a totalement modifié le sens même du mot « prédiction ». On quitte le domaine de la divination pour entrer dans celui de la science.
Grâce aux progrès réalisés dans la compréhension des mécanismes de nombreuses affections, il est aujourd'hui possible d'évaluer le risque pour un individu sain de développer une pathologie dans un avenir plus ou moins lointain et, si possible, de mettre en place des stratégies destinées à l'éviter. Prédire l'apparition d'une maladie avant les premiers symptômes, tel est l'objectif premier de la médecine prédictive, baptisée par certains « nouvelle médecine préventive individuelle ». Mais il y a aussi un autre champ d'intervention possible pour la médecine prédictive au niveau du fœtus, voire de l'embryon, pour éviter la naissance d'enfants atteints de maladies incurables ou gravement handicapantes.
Un bond dans la prédiction avec les progrès de la génétique
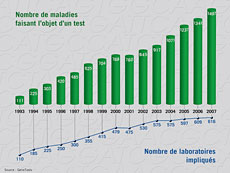
Depuis trente ans, la connaissance du génome humain et les outils pour l'explorer ne cessent de s'améliorer. Mais l'année 2007 restera probablement gravée comme l'année clé de la médecine prédictive. De fait, si les scientifiques ont séquencé l'intégralité du génome humain dès 2003 – après une première ébauche fortement médiatisée en 2001 –, il ne s'agissait que d'un patchwork d'ADN de plusieurs personnes.
C'est en 2007 que trois génomes individuels (celui du généticien américain Craig Venter, du prix Nobel James Watson et d'un inconnu chinois) sont séquencés pour la première fois. Résultat : on découvre alors qu'il y a cinq fois plus de différences génétiques entre deux individus que ce que l'on croyait jusqu'alors. Pour la revue américaine Science, il s'agit de la découverte majeure de l'année 2007. Sur les trois milliards de nucléotides que compte le génome humain, 15 millions varient d'un individu à l'autre. Déjà 3 millions de ces variations, appelées SNP (1), ont été découvertes. Or, en comparant ces variations entre individus malades et sains, les chercheurs mettent au jour un nombre croissant d'altérations génétiques associées à des maladies. En 2007, plus de 50 gènes ont été découverts, sur lesquels ces variations augmentent le risque de survenue d'une douzaine de pathologies.
1. SNP : en anglais Single Nucleotide Polymorphism ; il s'agit d'une mutation ponctuelle, c'est-à-dire d'un changement au niveau d'un nucléotide, constituant de base de l'ADN.
Ce que (pré)disent, ou pas, les tests
L'une des grandes difficultés de la médecine prédictive réside dans l'interprétation des résultats des tests. De l'analyse de l'ADN à celle des produits des gènes (protéines, enzymes), la panoplie des outils prédictifs est vaste. Mais rares sont ceux dont la valeur prédictive est certaine. En effet, les corrélations établies entre le marqueur biologique mesuré et le risque de développer une maladie sont de nature essentiellement statistique.
Pour une même altération génétique, une personne souffrira de symptômes graves alors qu'une autre restera indemne. Par ailleurs, la plupart de ces altérations n'augmentent que très légèrement – d'un facteur inférieur à 2 – le risque de développer une pathologie (1), et dépendent bien souvent de l'influence d'autres gènes ou de l'environnement. En 2007, une étude a ainsi identifié une mutation sur un gène (FGFR2) qui augmente le risque d'avoir un cancer du sein d'un facteur 1,2 (2). En comparaison, ce risque est augmenté d'un même ordre de grandeur chez les femmes dont la première grossesse survient après 30 ans (3) et il peut être réduit de 25 à 30 % par l'activité physique (4), ce qui relativise l'influence de ce gène et rend pour l'heure absurde toute application prédictive.
1. Source : Science, vol. 319, 18 janvier 2008. / 2. Une femme porteuse de cette mutation a 9,6% de risque de développer un cancer du sein tout au long de sa vie, contre 8% dans la population générale. Sources: Nature, vol 447, mai 2007; JAMA, vol 299, mai 2008. / 3. Source: Nature Genetics, vol 39, décembre 2007. / 4. Source: British Journal of Sports Medicine, mai 2008.
De la prédiction à la sélection
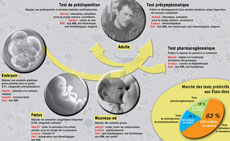
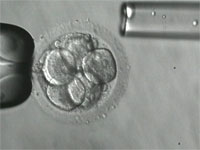
Le diagnostic préimplantatoire (DPI) consiste à réaliser, après une fécondation in vitro, un test génétique sur une ou deux cellules d'un embryon au stade huit cellules. Autorisé en France depuis 1999, il permet de sélectionner des embryons indemnes d'une altération génétique grave identifiée chez les parents. Quelques milliers d'enfants dans le monde, dont une centaine en France, sont nés via cette technique. Pour l'année 2005, 339 demandes de DPI ont été examinées en France, 254 ont été acceptées ; elles ont conduit à 21 accouchements et 26 naissances.Un futur bébé en « parfaite santé »…
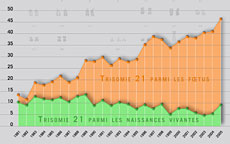
Désormais, de plus en plus d'examens sont réalisés sur le foetus pour dépister d'éventuelles maladies telles que des trisomies, des anomalies du tube neural ou, lorsqu'un doute existe, certaines maladies héréditaires. En France, on dépiste près de 70% des anomalies congénitales du bébé, contre 16 % en 1983 (1). Revers de la médaille : le taux d'amniocentèses (2) pratiquées pour confirmer un risque s'élève à 11 % dans l'Hexagone (3). Or, cet acte est loin d'être anodin puisqu'il entraîne une fausse couche dans 1% des cas. Toutefois, on peut maintenant analyser le génome des cellules du foetus directement dans le sang de la mère, sans passer par une amniocentèse.
Une nouvelle technique qui, associée à des outils toujours plus performants d'analyse du génome, pourrait annoncer l'avènement d'un dépistage prénatal bien plus large qu'aujourd'hui. Par ailleurs, les progrès dans les techniques d'assistance médicale à la procréation permettent de tester l'embryon avant même son implantation dans l'utérus.
Le diagnostic préimplantatoire (DPI) permet de rechercher et de sélectionner les embryons qui ne sont pas porteurs d'une mutation génétique présente chez les parents. Problème : pour réaliser un DPI, il faut passer par une fécondation in vitro. Une technique lourde pour la femme et qui augmente le risque d'enfants prématurés.
1. Source : J Gynecol Obstet Biol Reprod, vol 34, 2005 (derniers chiffres connus). / 2. L'amniocentèse consiste à prélever à travers le ventre de la mère un peu du liquide amniotique dans lequel baigne le bébé. L'échantillon est ensuite envoyé dans un laboratoire pour analyse. / 3. Source : BJOG, International Journal of Obstetrics and Gynaecology, mai 2004.
Eviter des maladies graves : pas si simple
Prévoir une maladie avant l'apparition des premiers symptômes permet, dans certains cas, la mise en oeuvre de mesures de prévention : changement de mode de vie, traitement permettant de retarder, voire d'éviter, l'apparition de la maladie. Par exemple, le dépistage chez le nouveau-né de la phénylcétonurie, une maladie du métabolisme rare, permet de placer immédiatement l'enfant sous régime alimentaire particulier et d'éviter ainsi l'apparition d'un retard mental.
Toutefois, les bénéfices des tests prédictifs sont souvent beaucoup plus complexes. Ainsi, l'identification de mutations sur le gène BRCA1 – induisant un risque de développer un cancer du sein de l'ordre de 50% d'ici l'âge de 50 ans contre 2% dans la population générale – permet aux femmes porteuses d'opter pour une surveillance par mammographie dès 30 ans, mais cela n'abaisse que modestement leur risque de mortalité ; autre option pour ces femmes : subir une ablation des seins – opération mutilante et traumatisante –, ce qui abaisse à moins de 2% le risque de mortalité dans les vingt ans qui suivent le test génétique (1). Enfin, il existe des cas où les tests prédictifs ne débouchent que sur une information. Le meilleur exemple en est la chorée de Huntington, une maladie neurodégénérative qui se manifeste à coup sûr en cas de test positif (en général autour de 50 ans) et pour laquelle aucun traitement n'existe à ce jour. Dans ce cas, la question se pose de connaître à l'avance un futur forcément douloureux.
1. Source : Expertise INSERM-FNCLCC, mise à jour 2004.



Commentaires
Réagir à cet article