Les progrès réalisés dans la détection précoce de la maladie d'Alzheimer laissent envisager la possibilité d'un dépistage des personnes à risque. Mais à quoi bon prédire la maladie si l'on ne sait toujours pas la soigner ? A l'occasion de la journée mondiale Alzheimer le 21 septembre 2008, le point sur cette délicate question.
Prévoir la maladie avec la TEP ?
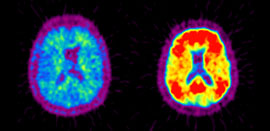
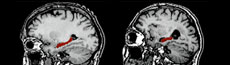
Parmi les grandes avancées dans la lutte contre la maladie d'Alzheimer, la possibilité de voir les lésions neuronales à l'origine de la maladie chez des individus sains offre un nouvel espoir : celui de pouvoir dépister des personnes à risque avant l'apparition des premiers symptômes. Il y a quelques années encore, il fallait en effet attendre un examen post-mortem pour observer les dépôts des plaques amyloïdes, caractéristiques de la maladie d'Alzheimer. Mais il est désormais possible de les visualiser grâce à la tomographie par émission de positons (TEP), une technique d'imagerie nucléaire qui utilise un traceur radioactif (le composé B de Pittsburg, dit PIB) capable de se fixer sur les dépôts amyloïdes. Une avancée particulièrement intéressante puisque ces plaques peuvent se déposer jusqu'à dix ans avant l'apparition des premiers symptômes… Toutefois, plusieurs problèmes se posent encore, et non des moindres.
Si la TEP détecte 100% des cas, elle repère également des lésions chez des personnes qui ne seront sans doute jamais malades. En effet, la présence de plaques amyloïdes dans le cerveau est fréquente chez les personnes âgées de plus de 75 ans (30% des cas). Par ailleurs, le traceur radioactif utilisé aujourd'hui par cette technique d'imagerie possède une durée de vie très courte : il perd la moitié de sa radioactivité toutes les 20 minutes. Conséquence : il faut obligatoirement le produire sur place pour pouvoir l'utiliser. Or peu d'hôpitaux possèdent un cyclotron capable de le faire. Enfin, l'appareil nécessaire pour cet examen coûte très cher (plus de 2 millions d'euros). Une dizaine de centres en France en sont pour l'heure dotés, principalement pour dépister la présence de tumeur. Seuls deux de ces centres l'utilisent pour confirmer un diagnostic de maladie d'Alzheimer (CEA d'Orsay et Cemerp de Lyon). Toutefois, la découverte de nouveaux traceurs aux durées de vie plus longues (notamment des composés marqués au fluor 18) devraient faciliter l'utilisation de cette technique.
Autre piste : mesurer le volume de l’hippocampe
Un logiciel permettant de mesurer de façon automatique le volume de l'hippocampe par IRM vient d'être mis au point par des chercheurs français. Une avancée intéressante car l'hippocampe est une structure cérébrale atrophiée, du fait de la perte de neurones, dès les premiers stades du développement de la maladie.
Cette technique pourrait donc s'avérer utile pour le diagnostic précoce mais vraisemblablement pas pour prédire la maladie avant l'apparition des premiers symptômes. Toutefois, certains spécialistes se demandent si la dégénérescence neuronale ne surviendrait pas avant le dépôt des plaques amyloïdes. Auquel cas, nous serions avec cette imagerie un peu plus en amont dans l'évolution de la maladie qu'avec la TEP. Pour l'heure, impossible de trancher. D'où la nécessité de mieux comprendre le mécanisme d'action de la maladie d'Alzheimer pour espérer pouvoir la combattre un jour.
Des biomarqueurs annonciateurs de la maladie
Un autre espoir en matière de dépistage précoce concerne l'utilisation de biomarqueurs prédictifs de la maladie. « Pour moi, ce sont les outils diagnostiques les plus prometteurs », affirme Luc Buée (Inserm), spécialiste de la maladie d'Alzheimer à l'Institut de médecine prédictive et recherche thérapeutique de Lille. Parmi ces marqueurs, certains peptides amyloïdes et la protéine Tau (les deux marqueurs des lésions cérébrales de la maladie) sont d'ores et déjà recherchés dans le liquide céphalo-rachidien dans quelques centres en France, généralement pour confirmer un diagnostic clinique chez des patients atteints de troubles de la mémoire. Et de nouveaux marqueurs ont été découverts ces dernières années, notamment l'enzyme BACE-1 à l'origine de la formation du peptide amyloïde. Or, la concentration de ces molécules dans le liquide céphalo-rachidien commence à être anormale plusieurs années avant la survenue des premiers symptômes de la maladie : par exemple, la quantité de protéines Tau augmente alors que celles des peptides amyloïdes diminue. Ces marqueurs pourraient donc servir de signal d'alarme chez des personnes encore saines. Problème : leur dosage nécessite aujourd'hui un examen invasif (il faut réaliser une ponction lombaire) et complexe techniquement. La recherche dans ce domaine s'oriente désormais vers l'utilisation de biomarqueurs sanguins.
Un test génétique en vente pour la forme familiale
Une compagnie américaine (Smart Genetics) vient de commercialiser un test génétique qui s'adresse aux patients atteints de la forme familiale de la maladie d'Alzheimer. Pour 249 dollars, une personne saine, sans aucun symptôme, pourra savoir si elle est porteuse de l'allèle Epsilon 4 du gène APOE, connu pour augmenter entre 3 et 15 fois le risque de développer la maladie. Ce sur-risque génétique concerne 1% des malades d'Alzheimer.
À quand un dépistage de masse?
Les progrès accomplis dans les techniques d'imagerie et de dosage de biomarqueurs pourraient-ils permettre d'envisager un dépistage de masse avant même l'apparition des symptômes ? Les médecins français se refusent pour l'heure à évoquer la question d'un dépistage généralisé.
Pour des raisons scientifiques d'abord : ces outils sont encore en cours de validation et pourraient détecter de nombreux "faux positifs", c'est-à-dire des sujets révélés porteurs de la maladie alors qu'ils ne le sont pas. Aussi pour des raisons pratiques : le coût et l'accessibilité à ces techniques limitent leur généralisation.
Enfin, pour des raisons éthiques : aucun traitement permettant de stopper ou de ralentir la progression de la maladie n'existe. Il serait donc inutile, voire néfaste, de dépister cette maladie avant les premiers symptômes puisque les seuls médicaments existants ne font que s'attaquer aux symptômes (troubles du comportement, perte de la mémoire…).
En attendant un traitement curatif...
Mais les choses pourraient bientôt changer car sur le front de la thérapie aussi, on observe des progrès. La 11° Conférence Internationale sur la maladie d'Alzheimer qui s'est tenue à Chicago cet été a ainsi mis en lumière deux avancées prometteuses. D'abord une nouvelle molécule en phase II d'essai clinique, le Rember, qui s'attaque directement aux amas de protéines tau qui se forment à l'intérieur des neurones et provoquent leur mort. Testé sur 321 patients au stade précoce et moyen de la maladie, le Rember aurait permis de réduire de 81% la vitesse de progression de la maladie. Toutefois, ces données n'ont pas encore été publiées et les spécialistes rappellent que bon nombre de molécules jugées prometteuses en phase II ont échoué lors de leur passage en essais clinique de phase III*.
L'autre espoir concerne l'immunothérapie. Un premier essai chez l'homme de vaccination active (où l'on injecte un antigène pour déclencher la fabrication d'anticorps dirigés contre les plaques amyloïdes) avait été arrêté en 2002 suite à des cas d'encéphalites. Une récente analyse des données** révèle que chez certains de ces patients traités, les plaques ont bien disparu mais aucune amélioration cognitive n'a pu être observée. En revanche, un essai d'immunisation passive (où l'on injecte directement l'anticorps chez les patients) est en cours d'essai de phase III. Lors de la précédente phase, une légère amélioration des symptômes avait été repérée mais elle était accompagnée d'effets secondaires (microhémorragie et œdème cérébral).
Si nous disposons un jour d'un traitement curatif,
faudra-t-il s'attendre à un dépistage chez des personnes saines ?
* La phase II détermine la dose optimale et contrôle les effets secondaires alors que la phase III compare la molécule avec un placébo ou un traitement de référence ; ** The Lancet juillet 2008