La repousse de neurones est possible dans le système nerveux central... L'équipe d'Alain Privat, de l'unité Inserm 583, à Montpellier, en apporte la preuve chez la souris. Derrière ces résultats se cache peut-être de nouvelles pistes pour l'élaboration de traitements de certaines pathologies du système nerveux chez l'homme.
Une preuve de principe
En juillet 2003, l'équipe d'Alain Privat (Inserm U583, Montpellier) annonçait dans les Comptes rendus de l'académie américaine des sciences être parvenue à régénérer des cellules du système nerveux central chez des souris dont la moelle épinière avait été sectionnée. Cette repousse avait permis aux animaux, devenus paralysés, de remarcher normalement.
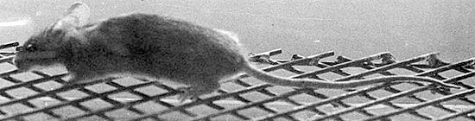
Dans la communauté scientifique, cette nouvelle a suscité de vives émotions. Depuis près d'un siècle, en effet, la régénération du système nerveux était considérée comme impossible, et ses lésions irréversibles. Par la suite, bien que cette repousse ait été observée dans le système nerveux périphérique (les nerfs et les ganglions rachidiens), ce dogme s'est maintenu pour le système nerveux central (cerveau et moelle épinière). Avec ces résultats, l'équipe d'Alain Privat a enfin apporté la “ preuve de principe “ montrant que la repousse des neurones dans le système nerveux central, et la restauration d'une activité motrice volontaire sont possibles.
Les neurones
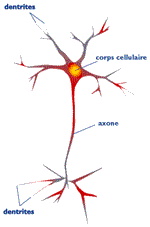
Pour assurer la transmission du message nerveux, les neurones ont une morphologie bien particulière : outre le corps cellulaire, qui renferme le noyau, ils sont dotés de fins prolongements, les dendrites et les axones. Les dendrites sont chargés de récolter les informations pour les transmettre au corps du neurone. L'axone, plus long, gère l'acheminement du message vers d'autres neurones, en se connectant aux dendrites des cellules voisines. Le fonctionnement du système nerveux repose donc sur la conduction du message à travers la structure très ramifiée du réseau de neurones. Lorsque le tissu nerveux est détérioré, les neurones ne sont plus connectés entre eux, et l'information ne passe plus. Selon l'atteinte, les conséquences varient. Dans la moelle épinière, les lésions provoquent des paraplégies, voire des tétraplégies. Au niveau du cerveau, les atteintes traumatiques entraînent parfois des hémiplégies, et la destruction anormale des neurones peut être à l'origine de pathologies comme la maladie d'Alzheimer ou celle de Parkinson.
Les gènes de la discorde
Le grand obstacle à la repousse des neurones, c'est la cicatrice qui se forme au niveau de la lésion. Les chercheurs ont émis l'hypothèse qu'elle constituait une barrière impénétrable, défavorable à la régénération des terminaisons nerveuses et donc à la restauration du contact entre les neurones.

La cicatrisation est assurée par deux protéines, la Vimentine et la GFAP (glial fibrillary acidic protein), produites par les astrocytes, des cellules auxiliaires du système nerveux central. Les chercheurs ont donc voulu savoir si l'absence de ces protéines inhibait in vivo le processus de cicatrisation, et permettait la repousse de neurones après lésion de la moelle épinière. Ils ont alors élaboré trois modèles de souris transgéniques : l’un dont le gène de la Vimentine était inactivé, l’autre dont le gène de la GFAP était inactivé, et un troisième modèle avec les deux gènes inactivés.
Toutes ces souris ont ensuite subi une hémisection de la moelle épinière, leur paralysant un membre postérieur. Un mois après cette lésion, les souris dont les deux gènes avaient été mutés ne présentaient pas de cicatrice, et étaient de nouveau capables de marcher sur une grille d'entraînement.
Les astrocytes
Longtemps considérés comme de simples cellules de soutien du système nerveux central, les astrocytes sont en réalité de précieux auxiliaires qui assistent les neurones dans de nombreuses tâches. Dès le développement du foetus, par exemple, ils forment un réseau de « rails » qui guident les cellules nerveuses encore immatures vers leur lieu de migration définitif. Puis, tout au long de la vie, ils constituent pour elles une source de nutriments (glucose) et synthétisent leurs facteurs de croissance. Parallèlement, les astrocytes protègent le système nerveux central en constituant la barrière hématoencéphalique, qui régule l’entrée des substances au niveau du cerveau. La cicatrice que génèrent les astrocytes au niveau d’une moelle épinière lésée joue avant tout un rôle de protection pour le système nerveux central. L’inhibition de la régénération des neurones en est un effet secondaire.
Vers une démarche thérapeutique
Depuis, les recherches que mène l'équipe d'Alain Privat visent à transposer les résultats obtenus avec les souris transgéniques à une stratégie thérapeutique. Avec l’équipe de Jacques Mallet (laboratoire de génétique moléculaire de la neurotransmission) à Paris, les chercheurs tentent actuellement de mettre au point des médicaments empêchant la cicatrisation. Ces substances seraient en réalité des petits bouts d'ARN capables de bloquer la synthèse des deux protéines, Vimentine et GFAP. Ce blocage pourrait rester local et être contrôlé dans le temps.
Les ARN qui « éteignent » les gènes
Les ARN dits « interférentiels» sont de courts fragments d’ARN (une vingtaine de nucléotides) capables d’empêcher la lecture de l’ARN messager, porteur de l’information génétique, et sa traduction en protéines. Ils ne désactivent que les gènes dont ils sont complémentaires. La technique consiste à cloner ces petits ARN, à les insérer dans le génome d'un virus rendu inoffensif, et, ici, à injecter ce virus modifié aux souris blessées, à proximité de la lésion. Les chercheurs attendent les résultats de ces nouvelles expériences pré-cliniques.
Un large panel de pathologies concernées
Si la stratégie permet d'éviter la formation de nouvelles cicatrices, pourra-t-elle également résorber les anciennes ? Bloquer la fabrication de la GFAP et de la Vimentine revient en effet à empêcher le renouvellement et l'entretien de la cicatrice. Celle-ci devrait donc se déliter progressivement et laisser le champ libre aux neurones. Mais ces derniers seraient-ils alors capables de repousser, longtemps après que la lésion ait eu lieu ?
« De nombreuses pathologies pourraient être traitées aussi bien dans le cas d'atteintes traumatiques que pour des maladies de dégénérescence du système nerveux. »
Les lésions aigües du SNC

Et chez l'homme...
L'équipe d'Alain Privat s'est donné cinq ans pour élaborer chez l'homme une stratégie thérapeutique efficace. Les études devront d'abord être menées sur des souris puis sur des singes, avant de faire l'objet d'essais cliniques chez des patients humains. Il faudra s'assurer que ce qui a été observé chez les animaux reste valable pour l'homme. Il se peut, par exemple, que l'on mette en évidence une troisième protéine impliquée dans le processus de cicatrisation. Les chercheurs ont d'ores et déjà listé une série de gènes potentiels !
Chez l’homme, comme chez la souris, le blocage des gènes des protéines de la cicatrisation pourrait être contrôlé pour n'avoir lieu que dans les astrocytes, au moment voulu. Les risques d'effets secondaires liés à l'inhibition prolongée de la synthèse des protéines seraient donc minimes. De plus, les vecteurs viraux pourraient être remplacés par des liposomes, des petites sphères de phospholipides inoffensives. Et le traitement s'administrerait par simple injection...


