Pour la première fois, deux équipes de chercheurs ont pu « filmer » les mouvements des atomes lors d’une réaction chimique simple. Une expérience qui pourrait dans l'avenir s'appliquer à des processus chimiques plus complexes.
Reportage dans l'infiniment petit
Filmer les molécules au cours des réactions chimiques : cette perspective a fait rêver plus d’un chimiste ! Et pour cause, si les scientifiques disposent de nombreuses méthodes pour étudier de manière approfondie les molécules avant et après réaction, le processus chimique en lui-même n’est souvent décrit que par la théorie.
À cela, plusieurs raisons. Lors d’une réaction chimique, les mouvements des molécules sont extrêmement brefs et ne durent typiquement que quelques picosecondes (10-12 s). Pour corser la chose, ils se déroulent à des échelles, non pas microscopiques, mais nanométriques (10-9 m) !
Malgré cela, deux équipes de chercheurs dirigées par le professeur Savo Bratos du Laboratoire de Physique Théorique des Liquides (CNRS, Paris) et par le professeur Michael Wulff de l’European Synchrotron Radiation Facility (ESRF, Grenoble) ont réussi à « filmer » la formation d'une molécule d’iode diatomique (I2) dans un liquide : une première* !
* Physical Review Letters, Vol. 92, n° 12, 125505-1 / Nature, vol. 429, p. 255
micro, nano, pico, femto…
micro, nano, pico, femto... sont des préfixes associés à des unités (seconde, mètre…) :
micro (µ)
10-6 soit 0,000 001 fois l’unité à laquelle ce préfixe est associé.
nano (n)
10-9 soit 0,000 000 001 fois l’unité à laquelle ce préfixe est associé.
pico (p)
10-12 soit 0,000 000 000 001 fois l’unité à laquelle ce préfixe est associé.
femto (f)
10-15 soit 0,000 000 000 000 001 fois l’unité à laquelle ce préfixe est associé.
Remarque : 1 Angström (Å) = 10-10 m, soit 0,1 nanomètres.
Dans la lignée d’Ahmed Zewail

Ces résultats prometteurs n’auraient sans doute pas pu voir le jour sans les travaux du professeur Ahmed Zewail, lauréat du prix Nobel de Chimie 1999.
Ahmed Zewail est en effet le premier à avoir montré comment l’étude des réactions chimiques pouvait être réalisée grâce à des flashs lasers extrêmement brefs (picosecondes puis femtosecondes).
Le principe qu’il a développé consiste à soumettre un milieu chimique à deux flashs successifs : le premier génère la réaction, le second permet d’analyser par spectroscopie les composés chimiques.
Cette technique révèle cependant ses limites : si elle permet effectivement de « voir » la formation ou la rupture d’une liaison chimique entre deux atomes, elle ne donne aucune indication sur la structure géométrique de la molécule.
Une telle structure peut être obtenue grâce aux rayons X. Cependant, la durée des flashs X est longtemps restée trop longue pour étudier les molécules en mouvement. Le problème est comparable à celui du photographe qui essaie de saisir l'image d'une voiture en pleine course en posant plusieurs secondes : l’image obtenue est floue, voire inexistante ! Une raison pour laquelle la technique d’analyse par « diffraction des rayons X » est essentiellement utilisée pour étudier la position des atomes dans un système statique, en l’occurrence dans un cristal.
Le synchrotron au secours des chimistes
Depuis peu, certains synchrotrons* à haute énergie – tel l’ESRF de Grenoble – sont capables de produire des flashs à la fois puissants et très brefs, de l’ordre de 60 à 120 picosecondes : un temps suffisamment court selon Savo Bratos et Michael Wulff pour pouvoir étudier une réaction chimique simple et peu rapide…
La réaction chimique retenue par les deux chercheurs est la photodissociation-recombinaison de l’iode en milieu liquide. Elle consiste à séparer les deux atomes d’une molécule d’iode (I2) à l’aide d’un flash laser et à observer sa reformation.
« Nous avons plusieurs avantages à choisir cette réaction, explique le professeur Savo Bratos. D’abord, la réaction est relativement lente : 140 picosecondes, un temps supérieur à celui des flashs X que nous sommes capables de produire. D’autre part, le processus chimique est bien connu puisque depuis les années 80, de nombreux laboratoires ont pu l’étudier en faisant appel à des lasers. Cette connaissance nous permet de vérifier que ce que nous observons correspond bien à la théorie. »
* Accélérateurs de particules capables de générer un rayonnement riche en rayons X.
SIlence, on tourne...
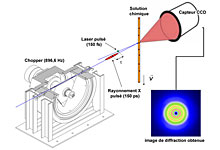
L’expérience, menée à l'ESRF sous la houlette du professeur Michael Wulff, se déroule de la manière suivante. Dans un premier temps, une solution de tetrachlorométhane (CCl4) contenant des molécules d’iode (I2) est soumise à un flash laser très bref de quelques femtosecondes. Ce tir laser fait littéralement exploser la molécule d’iode en deux atomes. Quelques picosecondes après, le milieu chimique est soumis à un flash de rayons X. L’image produite est alors recueillie par un capteur électronique (une caméra CCD).
« En répétant plusieurs fois ces étapes, tout en variant le délai entre le laser et le flash de rayon X, il est possible de produire plusieurs images et reconstituer le film de la réaction au cours du temps, explique Michael Wulff. Le dispositif peut ainsi être assimilé à une caméra moléculaire. »
Un film à décrypter
La séquence obtenue, qui regroupe 25 images, ne permet pas de « voir » directement les molécules. Ces images, dites « de diffraction », ne sont que le reflet des rayons X déviés par la structure des molécules.
Les puissants modèles théoriques développés par Savo Bratos et son équipe permettent cependant d’interpréter ces figures ésotériques et de déterminer, par exemple, la distance entre les atomes d’iode au cours du temps.
La distance qui sépare ces deux atomes est typiquement de 2,7 Å. Mais après le flash laser, les deux atomes, extrêmement chauds, se séparent. Bloqués par le solvant, ils oscillent très rapidement mais restent distants d’environ 4,5 Å. Après un millier de collisions contre les molécules du solvant, les atomes d’iode finissent pas se refroidir et se recombinent : leur écart est encore de 4 Å. 140 picosecondes après le début de l’expérience, la molécule retourne enfin à son état initial et la distance entre les deux atomes reprend sa valeur de 2,7 Å.
Les résultats correspondent donc bien à ce qui avait été décrit jusqu’à présent. Malgré tout, les chercheurs ont pu observer un phénomène inattendu : « Nous avons constaté un transfert d’énergie entre l’iode et le solvant, fait remarquer Michael Wulff. Les images de diffraction montrent ainsi que lors de la réaction, le solvant se dilate, sa température augmente de 2,7 kelvin et sa pression de 40 bars, soit la pression qui règne à 400 m sous les océans ! »
Un début prometteur
Les auteurs le reconnaissent eux-mêmes. Cette expérience, qui s’appuie sur une réaction simple et déjà longuement décrite, ne constitue qu’un début. Mais un début prometteur : les deux équipes obtiennent actuellement des résultats très intéressants sur des molécules bien plus complexes*.
De réels progrès ne seront néanmoins possibles qu’en réduisant toujours plus la durée des flashs X. La réponse viendra vraisemblablement des lasers à électrons libre qui pourront, à terme, produire des flashs de seulement 100 femtosecondes : 1000 fois plus courts que ce que l’on sait faire aujourd’hui. Un tel instrument – baptisé Linac Coherent Light Source (LCLS) – est actuellement en développement aux Etats-Unis et devrait être opérationnel dès 2009. L'Europe devrait également disposer, d’ici 2012, de son X-Ray Free-Electron Laser (XFEL).
* travaux actuellement en cours de publication