L'affaire du Furosémide a réactivé la méfiance des patients et des médecins à l'égard des médicaments génériques. Depuis leur lancement, au milieu des années 1990, ces médicaments ont trouvé leur place sur le marché français, quoique de manière plus modeste que dans les autres pays européens. Les doutes sur leur parfaite efficacité thérapeutique ne sont, de fait, pas tous dissipés.
L’affaire du Furosémide est close. Le 28 juin, après plusieurs semaines d’incertitude, le dossier a été classé sans suite par le parquet de Paris. À l’origine de cette polémique, l’alerte sanitaire lancée après le signalement d’un pharmacien de Saint-Malo : un comprimé de somnifère avait été retrouvé au sein d’une plaquette de Furosémide, un diurétique du laboratoire Teva, leader sur le marché des génériques. Au cours du mois de juin, plusieurs décès de personnes âgées avaient jeté le trouble sur cette erreur supposée. Or, après enquête, il se trouve qu’aucun problème de conditionnement ne peut être imputé au laboratoire Teva, et que la confusion provient vraisemblablement de la maladresse d’une personne âgée ayant échangé ses propres comprimés avant de les rapporter à son pharmacien. Reste que l’affaire avortée du Furosémide a réactivé les polémiques autour de la fiabilité des médicaments génériques et de leur dangerosité supposée.
Principe d'économie
En France, les médicaments génériques ont une histoire récente. Lancés dans le cadre du plan de réforme de la sécurité sociale dit « plan Juppé » en 1995, ils s’inscrivent dans une politique de santé qui permettrait à l’Etat et aux citoyens de faire d’importantes économies tout en apportant les mêmes bénéfices thérapeutiques que les médicaments de référence.
Le générique est la réplique d’un médicament autorisé - molécule « princeps » - ayant perdu son brevet. Le fabricant n’ayant pas à financer les frais de recherche et de développement, les génériques sont vendus moins chers que les médicaments originaux. Depuis janvier 2012, le prix du médicament générique doit d'ailleurs être inférieur de 60 % au médicament d'origine.
Selon un rapport de l’IGAS (Inspection générale des affaires sociales), les génériques représentaient, en 2012, 24 % des médicaments remboursables en France, contre 10 % en 2002. Ils auraient ainsi permis de réaliser une économie de 10 milliards d'euros, dont 7 milliards d'euros pour le seul régime général.
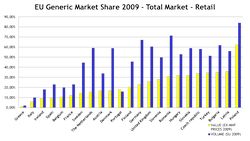
La France reste malgré tout très en retrait par rapport aux autres pays de l'Union européenne. En Allemagne, au Royaume-Uni ou au Pays-Bas, la part des génériques représente plus de 60 % des quantités de médicaments vendus. « Ces données doivent être interprétées avec prudence, car il faut prendre en compte les spécificités des marchés nationaux et des systèmes d’assurance maladie », relève toutefois l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Un marché en perte de vitesse
Loin d’être en bonne santé, le marché du générique s’essouffle depuis 2008, et a même chuté pour la première fois en 2011 de 3,1 % par rapport à 2010. Depuis 2012, cependant, on observe un léger regain dû à la mise en place du dispositif « accord tiers payant contre générique ».
Exprimant une certaine méfiance vis-à-vis des génériques, certains patients et professionnels accusent ces médicaments d’être moins performants que les originaux. De fait, la plupart des génériques ne sont pas des copies exactes des princeps. Certes, le principe actif est rigoureusement identique à l’original. Mais la forme pharmaceutique (gélule, comprimé, sirop...) peut être différente au même titre que les excipients transportant le principe actif. Ces différences sont acceptées à condition qu'elles n'affectent pas la bioéquivalence du générique par rapport à l'original.
En effet, quelle que soit la composition des génériques, des tests de bioéquivalence sont systématiquement réalisés pour démontrer leur efficacité thérapeutique. Ceux-ci visent notamment à évaluer leur « biodisponibilité », c’est-à-dire le devenir des principes actifs dans l’organisme (absorption, distribution, métabolisme et élimination), un caractère pouvant être affecté par les excipients ou les procédés de fabrication.
Selon la définition de l’ANSM, la bioéquivalence entre générique et princeps est établie lorsque la quantité de principe actif disponible (qui atteint la circulation sanguine) est la même ainsi que la vitesse de ce processus. Ces deux variables sont mesurées sur des sujets sains et doivent s’inscrire dans un intervalle de confiance de 80 à 125 %. Défini par l’Agence européenne du médicament, cet écart est identique à celui en vigueur pour les différents lots d’un même médicament princeps.
Différentes définitions
Le terme « générique » recouvre en réalité différents types de médicaments plus ou moins proches des princeps :
- Les auto-génériques fabriqués par le laboratoire détenant la molécule princeps sont de vraies copies. Ils ont été développés au début de la mise sur le marché en France en 1996. Il s’agit donc de la même molécule, du même dosage, de la même forme galénique et des mêmes excipients.
- Les médicaments similaires ont les mêmes principes actifs, le même dosage, la même forme que les médicaments originaux, mais pas les mêmes excipients.
- Les « assimilables » sont des médicaments plus éloignés des princeps car le principe actif, à dose égal, peut se présenter sous une forme chimique différente. La forme galénique peut également être différente (comprimé au lieu de gélule par exemple) de même que les excipients.
Une bioéquivalence remise en cause
La bioéquivalence du générique et du princeps est contestée par certains. En effet, dans un rapport de 2012, l’Académie nationale de médecine dresse une liste des reproches faits aux génériques. Elle affirme que « la bioéquivalence entre produit référent et générique ne signifie pas qu'il y a équivalence thérapeutique, en particulier lors de la substitution d'un générique par un autre ». Elle relève aussi « une moindre efficacité et des délais d’action plus longs » de certains antibiotiques génériques. Cette mise en cause porte sur la quantité du produit absorbé dans l’organisme, plus précisément leur concentration dans le sang par rapport à la quantité administrée.
Pour le Dr Sauveur Boukris également, auteur d’un livre polémique sur le sujet paru en avril 2013, Médicaments génériques, la grande arnaque (Éditions du moment), une équivalence de biodisponibilité ne garantit pas la bioéquivalence thérapeutique : « Le malade, lors d’une substitution, peut passer d’un générique avec 80 % d’efficacité à un générique avec 120 % d’efficacité, ce qui entraîne une augmentation du principe actif dans sa concentration sanguine de 40 % », explique-t-il, « et de fait, beaucoup de patients me disent que le générique est moins efficace que l’original et nous devons alors augmenter les doses ou la durée du traitement ». Un constat similaire est dressé par Rémy Gauzit, médecin au service de réanimation St Marthe de l’Hôtel-Dieu, à Paris, et expert externe de l’Afssaps. En 2011, il a compilé une vingtaine d’études sur le thème et relevé plusieurs différences d’efficacité entre princeps et génériques d’antibiotiques injectables.
Le cas particulier des médicaments à marge thérapeutique étroite
Certains médicaments nécessitent un dosage précis. Il en est ainsi des antiépileptiques, des anti-coagulants, des hypoglycémiants, ou de certains médicaments à visée cardiologique. Pour ces molécules à marge thérapeutique étroite, la variation de bioéquivalence est réduite à +/- 10 %. Tout en rappelant l'absence de problèmes liés à l'utilisation des génériques, l’ANSM ainsi que la Commission nationale de pharmacovigilance attirent l’attention sur la difficulté de substitution de ces médicaments à marge thérapeutique étroite.
Des excipients pas toujours neutres
Les génériques diffèrent principalement des médicaments originaux par leurs excipients. Ces molécules n'agissent pas sur les qualités pharmacologiques du médicament. Néanmoins, l'ANSM admet que certains excipients dits à effet notoire (EEN) tels que l'amidon de blé, l'aspartame ou l'huile d’arachide sont susceptibles de provoquer des effets secondaires comme des allergies, des intolérances ou des troubles digestifs. Ils exigent donc des précautions d’emploi chez certains patients.
Par ailleurs, les excipients peuvent induire des différences de forme, de consistance, de goût et de couleur. Il en résulte parfois un effet « nocebo » : inquiets face à un médicament inhabituel, certains patients développent des troubles bénins (troubles digestifs, maux de tête...).
Les différences de couleur, de forme galénique ou même d'emballage peuvent également déboucher sur des erreurs médicamenteuses : un problème qui touche surtout les personnes âgées et/ou qui prennent beaucoup de médicaments (dites « polymédicamentées »).
À noter que depuis le 21 décembre 2012, afin d'éviter ces effets indésirables, les génériques sont autorisés à imiter la forme, la consistance, la couleur ou le goût de leurs princeps.
Fabriqué à l’étranger = danger ?
L’affaire avortée du Furosémide a fait aussi ressurgir une autre inquiétude : celle de la provenance des médicaments génériques.
Les comprimés de Furosémide provenaient de Hongrie et étaient mis en plaquettes et en boîtes à Sens (Yonne), tandis que le somnifère Zopiclone provenait, lui, d'Espagne. En effet, bien que les médicaments vendus en France (originaux et génériques) soient assemblés et conditionnés en Europe, 80 % de leurs principes actifs proviennent de Chine ou d’Inde. La confiance, le respect des règles européennes de fabrication, des contrôles réguliers et poussés sont donc les bases d’une coopération solide. L’ANSM assure qu’aucun incident grave n’est à déplorer et que les sites inspectés donnent des résultats satisfaisants. Si nécessaire, elle procède à des alertes ou des retraits de lots suspects.
Mais pour l’Académie nationale de médecine, des doutes restent permis. Cette institution relève que « les règles de bonnes pratiques dans la fabrication des médicaments génériques sont très coûteuses et certains fabricants n’hésitent pas à les contourner, aussi bien dans des pays émergents comme l’Inde que dans des pays industrialisés comme le Canada, avec, par exemple, un cas rapporté concernant Apotex, le premier laboratoire pharmaceutique du pays ».
Cela étant, le faible prix des génériques – 60 % moins coûteux en moyenne que le princeps – contribue à la réduction du déficit de la branche assurance maladie de la Sécurité sociale. En outre, dans les pays en développement, ce sont les seuls médicaments qui permettent un accès aux soins. En Afrique, par exemple, ils contribuent directement à enrayer l'épidémie de Sida.
Le droit de substitution : le pharmacien décide
Depuis 1999, afin de favoriser le développement de l’utilisation des génériques, les autorités françaises ont accordé aux pharmaciens le droit de substitution, c'est à dire le droit de modifier une prescription médicale au profit d'un générique. Parallèlement, ils ont aussi obtenu de récupérer une marge similaire à celle des princeps. Ainsi sur son ordonnance le médecin doit inscrire « non substituable » en face du médicament prescrit, faute de quoi le pharmacien délivrera d'office un générique. Quant au patient depuis mai 2012, s'il refuse un générique il devra alors avancer la totalité des frais de médicament et attendre de se faire rembourser. Le pharmacien décide aussi du générique que recevra le patient selon les approvisionnements de son officine.