Aussi efficace qu'une campagne de prévention, l’annonce de la double mastectomie d'Angelina Jolie a mis à la une les risques encourus par les porteuses de certaines mutations génétiques. Quitte à caricaturer les dilemmes auxquels les femmes se trouvent confrontées...
« Pas une consultation oncogénétique sans que l’exemple d’Angelina Jolie ne soit mentionné ! raconte Catherine Noguès, onco-généticienne à l’institut Curie. Or la mastectomie prophylactique n’est pas forcément une bonne solution pour toutes les femmes porteuses de mutations du gène BRCA1/2, ou en tout cas pas à n’importe quelle période de leur existence ». La célèbre actrice nord-américaine avait annoncé dans le New York Times, à la mi-mai, avoir subi une double mastectomie - une opération aussi appelée mammectomie - afin de réduire ses risques de développer un cancer du sein (87 % de risque) et/ou un cancer de l’ovaire (50 %).
Intervention chirurgicale lourde, la mammectomie fait chuter la probabilité de survenue de ces cancers au niveau de la population générale, soit pour le cancer du sein 10 % toutes causes confondues. « Cette intervention est donc très efficace, mais entraîne des répercussions physiques, psychologiques et affectives », met en garde Catherine Noguès : « Pour être bien vécue, elle doit s’intégrer dans un projet mûrement réfléchi ». Signe de cette complexité, « les femmes changent parfois d’avis avec le temps, soit parce qu’elles sont lasses des examens de contrôle, soit parce qu’elles ont été marquées par la maladie d’un proche, soit parce qu’elles voient les choses différemment après avoir eu des enfants ».
L’alternative : une surveillance étroite
Les femmes porteuses de mutations des gènes BRCA 1/2 (de l’anglais BReast CAncer : cancer du sein) qui ne pratiquent pas de mastectomie prophylactique se voient proposer une surveillance renforcée : des examens bisannuels dès l’âge de 20 ans ; puis, à partir de 30 ans, une mammographie, une échographie et une IRM chaque année. L’ensemble des recommandations de prise en charge des femmes se trouvant dans cette situation est disponible sur le site de l’Institut national du cancer (Inca), au chapitre « suivi et chirurgie prophylactique ». Il s'agit naturellement d'une vigilance bien plus étroite que la mammographie annuelle à partir de 50 ans préconisée dans la population générale. Elle vise à détecter une éventuelle tumeur de manière précoce.
En effet, le cancer du sein a plutôt un bon pronostic : la survie à 5 ans atteint 89 % pour un diagnostic posé entre 2001 et 2004, constate l'Inca. C’est le fruit combiné des progrès thérapeutiques et d’un dépistage mieux organisé : 50 % des cancers du sein sont dépistés au stade de petite tumeur, soit une taille inférieure à 2 cm, contre 15 % en 1980. Mais si le taux de survie à 5 ans est de 88 % quand le cancer du sein est détecté au stade 1 (tumeur inférieure à 2 cm), il n’est que de 15 % lorsque, déjà métastasique, il atteint le stade 4, indique la Société américaine de cancérologie dans un rapport détaillé consacré au cancer du sein.
De son côté, la prévention du risque ovarien implique une échographie pelvienne annuelle dès l’âge de 35 ans. Mais l’imagerie ne permet pas toujours de détecter une tumeur précoce, aussi une annexectomie prophylactique (ablation de l’ovaire et des trompes), pratiquée sous cœlioscopie, est-elle conseillée à partir de 40 ans, malgré les inconvénients (une ménopause précoce notamment). En outre, le cancer de l’ovaire est asymptomatique et d’assez mauvais pronostic, justement car il est souvent diagnostiqué à un stade plus avancé. En France, 60 % des femmes concernées optent pour une intervention prophylactique, que les praticiens encouragent plus volontiers que la mastectomie, indique Catherine Noguès, de l'institut Curie.
Mutations et formes fortuites
Dans le cas des gènes BRCA1/2, les recommandations préventives sont donc bien établies. En revanche, au-delà d’une liste étroite de critères, les motifs de consultation le sont moins. La situation la plus simple est celle où un proche est connu comme porteur avéré de mutation : le résultat du test permet de déterminer qui, dans l’entourage, est également porteur, ce qui est le cas de la moitié de la parentèle.
Mais il s’agit des cas les moins fréquents. En effet, seules 13 à 14 % des personnes réalisant un test oncogénétique dans le réseau français présentent effectivement une telle mutation, alors qu’elles ont toutes une histoire familiale ou personnelle marquée par les pathologies cancéreuses, à l'origine du test. Soit, selon l’Inca, 15.000 femmes identifiées comme porteuses de mutations BRCA1/2 depuis 2003, dont un peu plus de la moitié apparentée à une personne malade du cancer. Au total, 0,2 % seulement des femmes de la population générale seraient porteuses de cette mutation.
Le plus souvent, c’est bien l’histoire familiale qui conduit à solliciter une consultation spécialisée : la répétition de cancers du sein et/ou de l’ovaire parmi les proches, surtout si des hommes ou des femmes de moins de 50 ans sont touchés. « Cela étant, la notion de critère familial demeure imprécise et doit être évaluée par un médecin », insiste Frédérique Nowak, responsable du département Innovation de l’Institut national du cancer (Inca). En effet, plusieurs femmes de l’entourage familial peuvent être touchées sans qu’aucun caractère héréditaire ne soit en cause… « Il ne faut pas oublier que le cancer du sein est très fréquent : tout le monde ou presque connaît une femme touchée par cette maladie », rappelle la spécialiste de l’Inca.
Il existe enfin un cas de figure que Dominique Stoppa-Lyonnet, professeur de génétique médicale à l’université Paris-Descartes, a baptisé « forme familiale fortuite » : « On n’identifie pas de mutation génétique, mais le risque par rapport à la population générale est élevé. Dans des formes familiales très sévères de cancers du sein et des ovaires, on va jusqu’à recommander une chirurgie prophylactique, y compris en l’absence de mutation de gènes BRCA1/2 ».
Un risque revu à la baisse
C’est dire que la caractérisation des risques n’est pas simple. Sa mesure se situe d’ailleurs dans une fourchette statistique assez large. L’oncogénétique, cette spécialité médicale qui étudie les liens entre l'hérédité et certains cancers, est en effet une discipline jeune : les premiers gènes ont été identifiés dans la première moitié des années 1990 (une centaine est répertoriée à ce jour). « Au départ, on a donc travaillé sur des populations emblématiques des mutations de BRCA1/2 et obtenu des taux de risque extrêmement élevés », explique Frédérique Nowak, de l’Inca, « mais depuis, on a revu ce sur-risque à la baisse ».
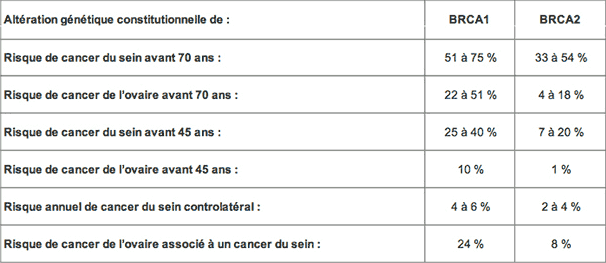
Selon les dernières estimations, les mutations des gènes BRCA1 (sur le chromosome 17) et BRCA2 (sur le chromosome 13) signalent un risque de survenue d’un cancer du sein de 50 à 70 % et du cancer des ovaires de 10 à 40 %. Dans le cas d'Angelina Jolie, il s'agit du gène BRCA1. Les chiffres de 87 % et 50 % qu'elle mentionne sont donc plus proches des résultats des études les plus anciennes que des estimations récentes.
Enfin, un lien rare et ténu avec les cancers du pancréas et de la prostate reste à confirmer et à mesurer.
Les années du risque
Spectaculaires, les chiffres décrivent « le risque cumulé d’une femme jeune tout au long de sa vie », insiste encore Catherine Noguès. Bien différente est la perception si on considère le risque annuel par tranche d’âge, qui n’atteint jamais 5 %, comme le rappelle l'Inca dans son rapport consacré à la chirurgie prophylactique.
En outre, ce facteur génétique se combine avec d’autres paramètres – mode de vie, statut hormonal, environnement de vie et de travail notamment – si bien que le risque réel est d’abord individuel : « La même mutation n’aura pas les mêmes répercussions pour deux familles différentes, ni au sein d’une famille donnée », explique Frédérique Nowak, de l’Inca. Rappelons aussi que seuls 5 à 10 % des cancers du sein sont d’origine héréditaire (toutes mutations confondues : p53, PTEN, CDH1, BRCA).
Un risque vécu différemment selon les pays
Ce qui complique, naturellement, le choix de l’attitude à tenir face à une annonce de gène BRCA1/2 muté. En France, les statistiques relatives aux ablations préventives sont tirées de Genepso, une cohorte nationale de porteurs(ses) de mutations BRCA1/2. « Sur les 2.400 personnes de la cohorte, en grande majorité des femmes, explique Catherine Noguès, 1.200 n’avaient pas développé de cancer il y a six mois, lors de la dernière analyse de données. Parmi elles, 7 % avaient pratiqué une mastectomie prophylactique et ce chiffre est plutôt orienté à la hausse. Mais l’âge moyen d’entrée dans la cohorte est de 40 ans. Le pourcentage de mammectomies préventives serait inférieur si cet âge d’entrée moyen était de 20 ans ».
Ce pourcentage est très sensiblement inférieur à celui avancé pour les États-Unis : 30 % de mastectomies préventives. Un chiffre à prendre avec des pincettes, car dans ce pays, il n’existe pas d’estimation fédérale et les chiffres varient d’un établissement hospitalier à l’autre. Mais aux Pays-Bas, il atteint 50 %. Catherine Noguès avance cependant des hypothèses pour expliquer l’opposition entre la France et les Etats-Unis : « Le rapport au risque est différent dans les pays anglo-saxons et les pays latins, ainsi que le contexte de prise en charge et le niveau de protection sociale ».
L’aspect financier de la prise en charge ne constitue pas une contrainte lourde en France. Les soins bénéficient du dispositif de l’affection longue durée (ALD) et incluent l’opération et la chirurgie reconstructive. Quant au suivi, il est remboursé au même titre que les soins habituels de santé. La chirurgie prophylactique bénéficie d’une prise en charge à 100 % dans certains cas. Enfin, la prescription et la réalisation des tests oncogénétiques sont gratuites pour les familles dans les consultations spécialisées mises en place dans le cadre du Plan cancer. C’est loin d’être le cas aux États-Unis : le prix du test génétique avoisine 3000 dollars, explique Angelina Jolie dans My Medical Choice. C’est coûteux, certes, mais moins qu’un éventuel traitement anticancéreux qui peut atteindre 250 000 dollars, témoigne une lectrice du New York Times, Judith M. Wallace...
Genepso, la référence sur les mutations du gène BRCA1/2
Mise en place en 2000, la cohorte Genepso rassemble aujourd’hui 2.400 personnes, soit 20 % environ de la population française porteuse des mutations du gène BRCA1/2. Coordonnée par Catherine Noguès, oncogénéticienne à l’institut Curie, elle s’efforce de répondre à de multiples interrogations : pourquoi certaines personnes ou familles développent-elles un cancer de l’ovaire plutôt que du sein ? Pourquoi dans certaines familles, les pathologies se déclarent-elles vers l’âge de 40 ans et dans d’autres, entre 30 et 70 ans selon les personnes ? Quels sont les rôles respectifs des facteurs environnementaux, familiaux (nombre d’enfants), hormonaux, alimentaires, génétiques et psycho-sociaux ? Les données réunies dans Genepso permettent de disposer de statistiques constamment actualisées sur les pourcentages de chirurgie préventive, mammaire ou ovarienne.