C'est l'exemple parfait d'un scénario où les scientifiques ont assuré leur rôle d'alerte, où les politiques ont suivi en interdisant les molécules incriminées et où les industriels ont joué le jeu en recherchant activement des substituts moins nocifs. Toutefois, plus de deux décennies après sa découverte, le fameux « trou d'ozone » ne se résorbe toujours pas. Et de nombreuses interrogations subsistent… Reportage.
Un faisceau vert dans le ciel de l’Antarctique
La nuit tombe sur la base scientifique de Dumont d'Urville, en Antarctique. Les étoiles commencent à scintiller dans le ciel glacé. Les manchots sont presque silencieux. Soudain, un faisceau vert apparaît. Un rayon vertical si haut qu'il se perd dans les étoiles. On dirait un immense sabre laser tout droit sorti de la « Guerre des étoiles ».
Pourtant, point de Jedi ici. Ce faisceau lumineux est issu d'un instrument appelé Lidar (pour LIght Detection And Ranging) et provient du laboratoire de géophysique. Là, deux scientifiques s'activent dans une salle bruyante baignée d'une étrange lumière verte. Leur objectif ? Mesurer la concentration d'ozone juste au-dessus de la base scientifique française, à plusieurs dizaines de kilomètres d'altitude. Ce laser vert, qui paraît continu, est en réalité constitué d'une multitude de faisceaux pulsés, d'une durée de 10 nanosecondes, tirés tous les dixièmes de seconde. Ces impulsions lumineuses interagissent avec les molécules d'ozone et le signal qu'elles renvoient renseigne non seulement sur la quantité d'ozone mais aussi sur son altitude.
L’ozone, carte d’identité

L'ozone est une molécule instable composée de trois atomes d'oxygène (O3). On en trouve près du sol, où il est toxique pour les voies respiratoires. Généré par la pollution, notamment automobile, cet ozone dit troposphérique voit sa concentration augmenter depuis plus d'un demi-siècle. Toutefois, 90% de l'ozone se trouve beaucoup plus haut en altitude, entre 15 et 50 km, dans la stratosphère. Cet ozone-là résulte d'un équilibre entre sa formation (par l'action du rayonnement solaire sur les molécules d'oxygène) et sa destruction (par réaction avec des constituants de l'atmosphère). A cette altitude, l'ozone est absolument essentiel à la vie sur Terre puisqu'il représente l'unique absorbant du rayonnement solaire ultraviolet susceptible de détruire l'ADN des cellules et d'inhiber la photosynthèse. L'épaisseur intégrée de cette couche d'ozone est très faible et varie selon les régions entre 2,4 mm au-dessus des tropiques à 4,5 mm au-dessus des pôles. Elle varie également énormément selon l'époque de l'année et même l'heure de la journée.
Une « success story » environnementale…
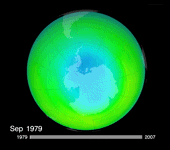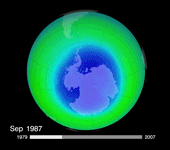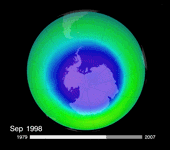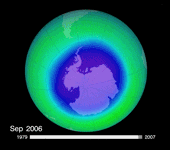
Si les mesures par Lidar sont relativement récentes, voilà plus d'un demi-siècle que l'on mesure la concentration d'ozone au-dessus de l'Antarctique grâce à d'autres instruments au sol, des ballons météo ou des satellites. C'est d'ailleurs ici, sur le continent blanc, qu'a été rapportée pour la première fois en 1985 la preuve d'une drastique diminution de la concentration d'ozone dans la haute atmosphère.

En réalité, on avait déjà mesuré cet appauvrissement quelques années plus tôt grâce à des satellites dédiés à l'ozone. Mais les données paraissaient tellement délirantes que les scientifiques avaient préféré ignorer ces résultats, pensant qu'il s'agissait d'une erreur technique. Il a donc fallu attendre 1985 pour que des scientifiques anglais du British Antarctic Survey publient, grâce à des instruments éprouvés et validés, leurs résultats dans la revue Nature*. Conclusion : l'épaisseur totale de la couche d'ozone au mois d'octobre a diminué en moyenne d'un tiers en l'espace de dix ans.
Dès lors, deux écoles s'affrontent. L'une estime que cette diminution aurait pour origine des effets dynamiques naturels de la stratosphère. L'autre suggère que son origine se trouve dans l'augmentation des chlorofluorocarbures (CFC) émis par l'homme. C'est à la seconde que l'histoire donnera raison. Dès 1986, les fautifs sont bel et bien identifiés : les CFC, utilisés depuis les années 50 par les industriels du froid, des aérosols et des mousses synthétiques, sont effectivement très stables dans la basse atmosphère. Mais dès lors qu'ils arrivent dans la haute atmosphère, quelque 10 à 15 années après leur émission, ils se décomposent sous l'effet du rayonnement plus intense et libèrent du chlore et du brome, capables de détruire l'ozone. Cette nouvelle produit un électrochoc dans les pays industrialisés du Nord, les plus gros émetteurs de CFC. Un simple frigo en France peut provoquer un trou dans la couche d'ozone à plus de 15 000 km de là, au-dessus du pôle Sud ! Autrement dit, la planète forme un tout. Et un rien peut la détraquer.
L'année suivante, en 1987, un premier traité international (le protocole de Montréal) sur la production et les émissions des produits incriminés par les scientifiques, est signé par 24 pays**. Ses amendements successifs conduisent à la suppression quasi-totale de la production de CFC dans les pays développés dès 1996 et prévoit leur interdiction dans les pays en voie de développement d'ici 2010.
* J. Farman et al., Nature, 315, 207, 1985 ; ** Le protocole de Montréal est aujourd'hui signé par 191 pays.
Comment les CFC détruisent l’ozone ?
Les composés chlorés issus des CFC sont transportés jusque dans les pôles, en une dizaine d'années. Là, associés à l'intense rayonnement solaire et aux basses températures, ils brisent les liaisons oxygène de l'ozone. Voilà pourquoi le trou de l'ozone s'observe principalement au-dessus de l'Antarctique, où les températures sont les plus basses, et au printemps, lorsque le soleil réapparaît.
… dont les effets se font encore attendre
Mais plus de vingt ans après le protocole de Montréal, force est de constater que l'on n'observe aucune reconstitution flagrante de la couche d'ozone… La taille du « trou » semble jouer au yo-yo. Après avoir beaucoup augmenté dans les années 1980, il s'est stabilisé vers 1995. En 2002, on criait victoire devant une spectaculaire diminution de sa superficie. Mais un an plus tard, sa surface atteignait à nouveau les valeurs de la fin des années 90, soit autour des 25 000 km². En 2006, on battait même le record, avec une superficie de 29,5 millions de km². Selon le dernier bulletin de l'Organisation météorologique mondiale (OMM), cette superficie atteignait 27 millions de km² le 13 septembre 2008.

Pourquoi n'observe-t-on pas un rétablissement plus rapide ? D'abord parce que le temps de présence des CFC dans l'atmosphère est très long (les substances les plus destructrices ont une durée de vie de 100 ans !). Donc pour qu'ils disparaissent totalement de l'atmosphère, il faudra encore attendre plusieurs dizaines d'années. Ensuite parce que ce processus de destruction d'ozone semble s'auto-entretenir. De fait, la diminution de la concentration en ozone induit une moindre absorption du rayonnement UV, et donc un refroidissement de la stratosphère. Or ces basses températures favorisent la formation de nuages stratosphériques polaires, à la surface desquels les réactions chimiques de destruction ont lieu. Enfin, dernier élément, il a également été démontré que l'accroissement des émissions de gaz à effet de serre pouvait retarder le rétablissement du trou en refroidissant également la haute atmosphère.
Les substituts aux CFC, la solution ?
Pour remplacer les CFC, les industriels ont mis au point des hydrochlorofluorocarbones (HCFC), qui sont des CFC hydrogénés. Leur avantage : ils sont moins stables que les CFC et réagissent donc plus rapidement à une altitude où la quantité d'ozone est moins importante. Toutefois, ces produits peuvent tout de même détruire des molécules d'ozone. Le protocole de Montréal prévoit d'ailleurs l'élimination de ces substances dites "de transition", en 2030 pour les pays développés et en 2040 pour les pays en développement. D'où l'invention d'un autre substitut : les hydrofluorocarbones (HFC), lesquels ne contiennent pas de chlore. Ils ne peuvent donc en aucun cas attaquer l'ozone. Problème : les HFC sont des gaz à effet de serre plus puissants que les HCFC. Ils font même partis des 6 gaz visés par le protocole de Kyoto…
Un exemple à suivre
Selon la plupart des modèles, il faudra attendre 2060 ou 2075 pour retrouver des valeurs de concentration d'ozone identiques à celles qui prévalaient avant 1980. Les marges d'erreur de ces modèles sont certes importantes, mais l'espoir de voir se résorber un jour le trou d'ozone est bien réel parmi la communauté scientifique internationale, qui cite volontiers l'ozone en exemple. Exemple d'une interaction positive entre les scientifiques, les politiques. et les industriels. Exemple aussi d'une collaboration internationale efficace face à un problème écologique majeur.
« Lorsque les pays signent les protocoles, ça peut marcher », constate Christine David, de l'Institut Pierre-Simon Laplace à Paris, qui aimerait voir là un signe encourageant pour le protocole de Kyoto. Reste que les enjeux ne sont pas les mêmes : s'il était relativement facile d'interdire les CFC, il en va tout autrement pour les combustibles fossiles. Et les industriels ne se bousculent pas pour trouver des substituts au carbone…